Grundlagen
Amyotrophe Lateralsklerose (ALS) ist eine schwere, bisher nicht heilbare Erkrankung des motorischen Nervensystems. Bei der ALS verlieren die motorischen Nervenzellen, die für die willkürliche Steuerung der Muskulatur verantwortlich sind, fortschreitend ihre Funktion.
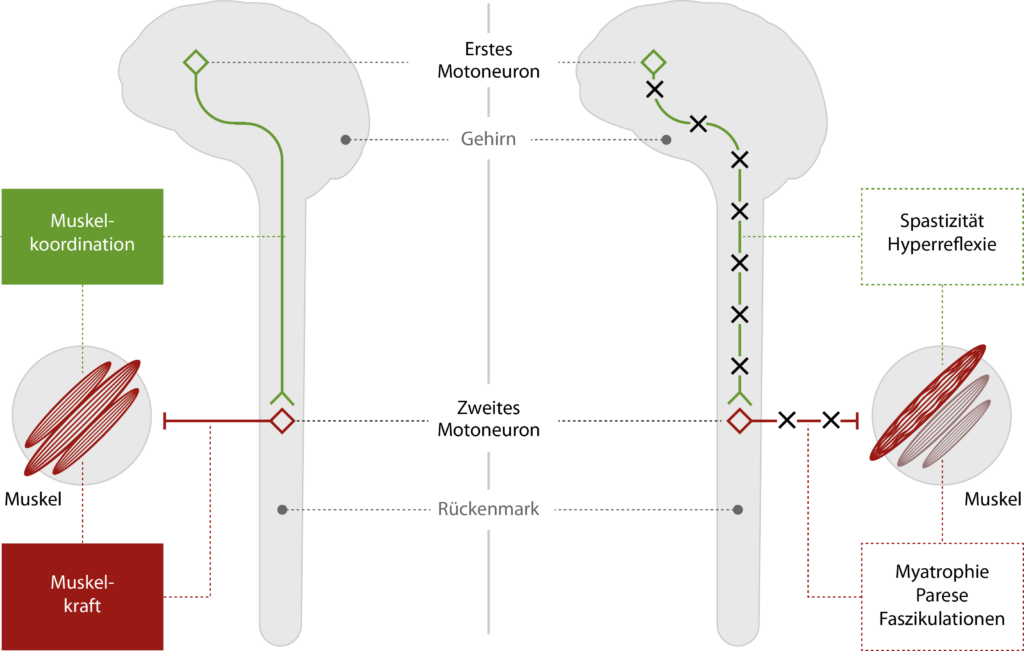
Abbildung: Aufbau des motorischen Nervensystems und typische Symptome der ALS. Bei der ALS kommt es zu einer Degeneration der Motoneurone, die für die Steuerung der Willkürmuskulatur verantwortlich sind. Die Schädigung des ersten Motoneurons (im motorischen Kortex) verursacht eine Spastizität (Bewegungsstörung), während die Degeneration des zweiten Motoneurons (im Myelon) mit Muskelschwäche (Parese), Muskelatrophie (Myatrophie) oder Muskelzuckungen (Faszikulationen) verbunden ist.
Der Abbau von Nervenzellen (Neurodegeneration) stellt sich für Menschen mit ALS vor allem als Kraftminderung und Muskelschwäche, Muskelschwund oder Steifigkeit dar. Der Nervenzellverlust hat zur Folge, dass die Mobilität der Hände, Arme, Beine sowie des Rumpfes und der Zunge im Laufe der Krankheit eingeschränkt wird oder verloren geht. Nicht betroffen von der ALS sind die Körperwahrnehmung und Sinneswahrnehmungen (Sehen, Hören, Schmecken, Riechen, Gleichgewichtssinn, Tastsinn). Auch die Herzmuskulatur und die Kontrolle von Urin und Stuhl bleiben meist unberührt. Im fortgeschrittenen Krankheitsverlauf kann es zur vollständigen Lähmung der Skelettmuskulatur kommen. Die ALS zählt daher zu einer der schwersten Erkrankungen des Menschen. Sie ist nicht heilbar, durch eine Behandlung können ihre Symptome jedoch gelindert werden.
Häufigkeit
In Deutschland leben 6.000 bis 8.000 Menschen mit ALS. Die Erkrankung wird jährlich bei etwa 2.000 Patienten neu diagnostiziert. Die meisten von ihnen sind zwischen 50 und 70 Jahre alt. Das Durchschnittsalter liegt zwischen 56 und 58 Jahren. 10 % erkranken vor dem 40. Lebensjahr. Die jüngsten Patienten sind zwischen 20 und 30 Jahre alt. Männer erkranken etwas häufiger als Frauen.
Zelluläre und molekulare Veränderungen
Die ALS wurde erstmalig im Jahr 1869 durch den französischen Neurologen Jean-Martin Charcot beschrieben und als „Amyotrophe Lateralsklerose“ bezeichnet. Er kam zu der Erkenntnis, dass die ALS durch einen Untergang (Degeneration) motorischer Nervenzellen in Gehirn und Rückenmark entsteht.
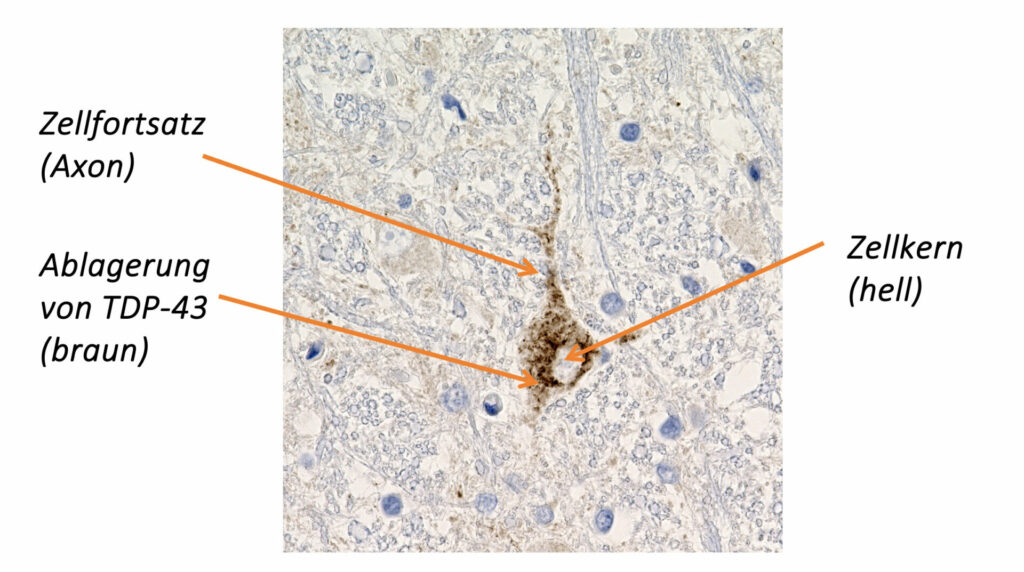
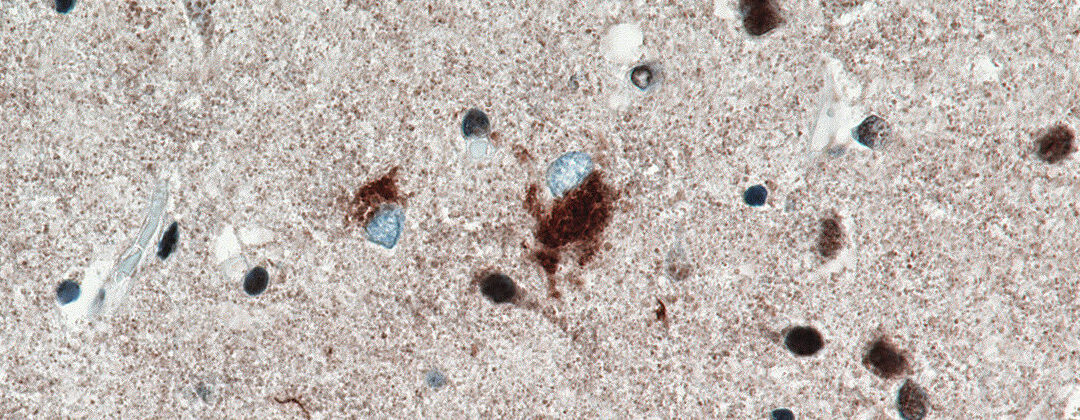
In den 1950er-Jahren konnten ALS-Forscher durch mikroskopische Untersuchungen von Gehirn- und Rückenmarksgewebe ALS-typische Ablagerungen von Eiweißen feststellen.Erst seit dem Jahr 2006 ist es gelungen, die molekulare und chemische Zusammensetzung dieser pathologischen Ablagerungen in den motorischen Nervenzellen zu analysieren. Ein hauptsächlicher Bestandteil der Ablagerungen besteht aus dem Eiweiß (Protein) TDP-43. Darüber hinaus konnte gezeigt werden, dass sich neben dem TDP-43 auch andere Proteine (z. B. SOD1, FUS) in der motorischen Nervenzelle ablagern können.
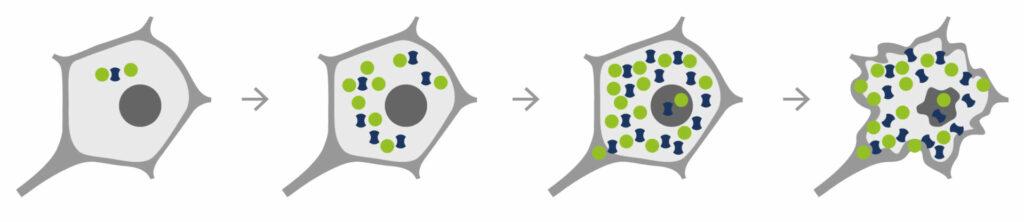
Ein Grundprinzip der ALS besteht darin, dass natürlich vorkommende Eiweiße eine Strukturänderung erfahren – ihre Form ändert sich (Konformationsänderung). Durch die Verformung kommt es zu einer gegenseitigen Anziehung der Eiweiße und es entstehen Zusammenballungen (Proteinaggregate). Nach dem Schneeballprinzip verbinden sich mehr und mehr Eiweiße miteinander. In der Konsequenz ist die Nervenzelle mit Proteinaggregaten überladen und kann ihre Funktion nicht mehr ausüben. Dieser Prozess der schädlichen Eiweißablagerung wird Proteinopathie genannt.
Zentrale Rolle von TDP-43
TDP-43 spielt eine zentrale Rolle in der Pathogenese der ALS. Unter normalen Bedingungen befindet sich dieses Protein im Zellkern, wo es an der Regulation der Genexpression beteiligt ist. Bei mehr als 90 % aller Menschen mit ALS wird jedoch eine krankhafte Veränderung dieses Proteins beobachtet: TDP-43 verlässt den Zellkern, lagert sich im Zytoplasma der Nervenzellen ab und bildet dort unlösliche Aggregate.
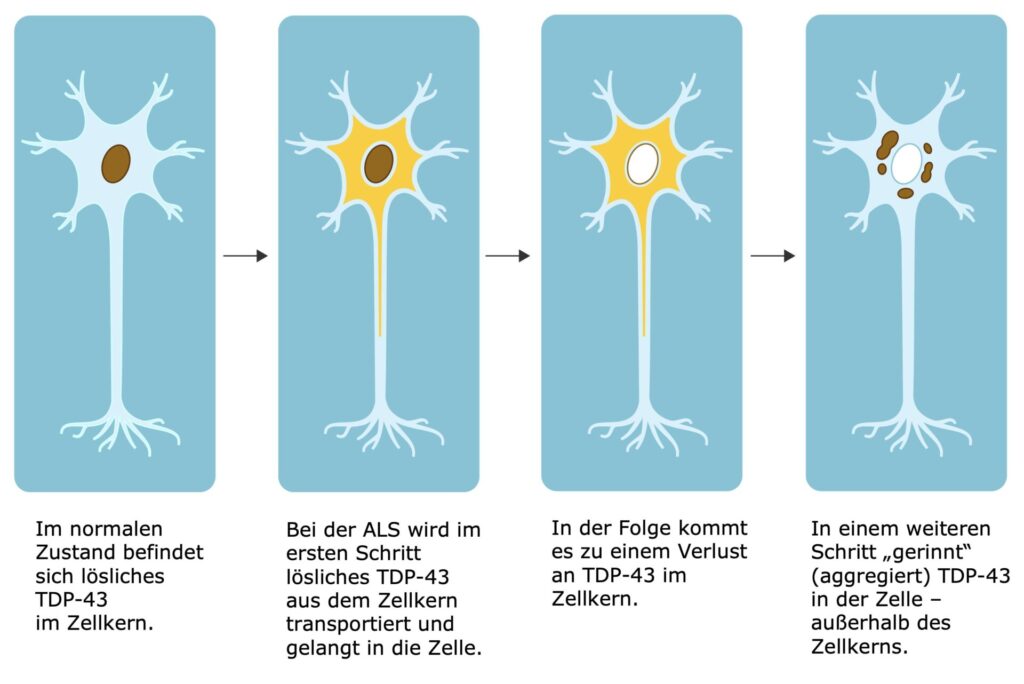
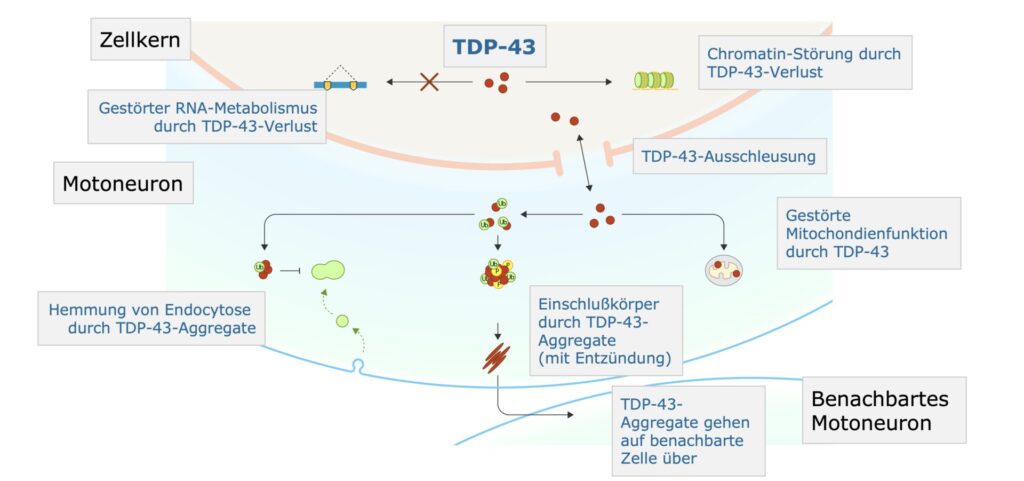
Die pathologische Verlagerung von TDP-43 aus dem Zellkern ins Zytoplasma spielt eine zentrale Rolle im Pathomechanismus der ALS. In der normalen, physiologischen Rolle ist TDP-43 ein nukleäres Protein (im Zellkern befindlich), das eine wichtige Funktion im RNA-Metabolismus erfüllt. Kommt es jedoch zu einem Verlust von TDP-43 im Zellkern, resultiert daraus eine Störung des RNA-Stoffwechsels. Diese Dysregulation betrifft alternative Spleißvorgänge (engl. splicing) und reduzierten RNA-Stabilität, die zur neuronaler Dysfunktion beiträgt. Parallel dazu verursacht der Verlust von TDP-43 im Zellkern auch eine Störung der Chromatinstruktur. Dies beeinträchtigt die Genexpression, insbesondere von Genen, die für das Überleben von Motoneuronen essenziell sind. Die Verlagerung von TDP-43 ins Zytoplasma führt außerdem zur Bildung pathologischer Aggregate, die zahlreiche zelluläre Prozesse beinträchtigen. So blockieren sie die Endozytose – die Aufnahme und Verarbeitung extrazellulärer Moleküle. Gleichzeitig führen sie zu einer Hemmung der mitochondrialen Funktion, die für den Energiestoffwechsel der Zelle elementar ist. Die Aggregate können sich zu Einschlusskörpern weiterentwickeln, die oft mit Entzündungsreaktionen einhergehen. Diese Entzündungen schädigen die Zellen zusätzlich, indem sie toxische Mediatoren freisetzen und die Immunantwort aktivieren. Ein weiterer kritischer Aspekt ist die Fähigkeit der TDP-43-Aggregate, von einer betroffenen Zelle auf benachbarte Zellen überzugehen. Dieser Prozess fördert die Ausbreitung der Pathologie innerhalb des zentralen Nervensystems.
Genetische Faktoren
Familiäre und genetische ALS
Bei 5-6 % aller Menschen mit ALS sind mehrere Familienmitglieder von ALS betroffen – es liegt eine “familiäre ALS” (F-ALS) vor. Die Rolle genetischer Faktoren wird noch unterschätzt, da bei mindestens 10 % aller Patienten, die keine Familiengeschichte einer ALS aufweisen, genetische Veränderungen vorliegen (“genetische ALS”).
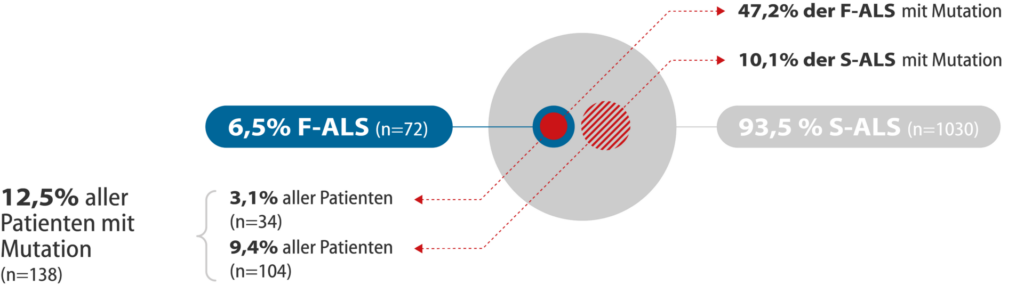
Abbildung: Häufigkeit von familiärer (F-ALS) und sporadischer ALS (S-ALS). Ergebnisse aus dem genetischen Screening-Programm in Deutschland
ALS-Gene
Die Ursachen der ALS werden kontinuierlich weiter aufgeklärt. Seit 1993 wurden über 20 Gene identifiziert, bei denen bestimmte Fehler (Mutationen) zu einer FALS führen können. Die häufigsten Mutationen finden sich in den Genen „C9orf72“, „SOD1“, „FUS“, „TARDBP“ und „TBK1“. Die genetische Diagnostik ohne Familiengeschichte einer ALS bedarf einer sorgfältigen, individuellen Abwägung und ärztlichen Beratung. Dabei ist zu beachten, dass bereits das Wissen um das Vorliegen einer Mutation mit psychosozialen Belastungen für die Betroffenen und/oder die genetisch-verwandten Familienmitglieder bedeuten kann. Gleichzeitig kann der Nachweis einer genetischen Veränderung (insbesondere im SOD1-Gen) mit einer Therapieoption (einer Behandlung mit dem genetischen Medikament Tofersen) verbunden sein. In jedem Fall sollte eine molekulargenetische Untersuchung von ALS-Genen erst nach einer fachärztlichen Beratung realisiert werden, in der Ziele, Grenzen und potentiellen Belastungen der humangenetischen Diagnostik dergestellt werden.
Symptome
Zu Beginn der ALS nehmen Patienten überwiegend Muskelschwäche (Parese), Muskelschwund (Atrophie) sowie Muskelsteifigkeit (Spastik) wahr. Die individuellen Beschwerden hängen davon ab, welches Motoneuron und welche Muskelgruppe stärker betroffen ist.

Zu 60 bis 70 % treten die ersten Symptome an den Extremitäten auf. In diesen Fällen bemerken Patienten eine Ungeschicklichkeit der Hände, eine Gangunsicherheit oder eine Schwäche der Beine. Zu 30 bis 40 % stellen sich die ersten Symptome beim Sprechen und Schlucken ein (bulbärer Krankheitsbeginn). Bei diesen Patienten ist die Zungen-, Schlund- und Gaumenmuskulatur beeinträchtigt.
Mobilitätseinschränkungen
Durch Muskelschwund und Steifigkeit wird die betroffene Extremität fortschreitend gelähmt. Sind zuerst die untern Extremitäten (Beine und Füße) betroffen, bedeutet dies eine zunehmende Gehstörung bis hin zur Notwendigkeit einer Gehstütze oder eines Rollstuhls. Bei den oberen Extremitäten werden das Heben, Tragen, Schreiben, Schneiden, Essen und die Körperpflege fortschreitend beeinträchtigt.
Sprechstörung (Dysrthrie)
Wenn die Symptome an Zunge, Schlund und Gaumen betreffen, kann eine Sprechstörung (Dysarthrie) entstehen. Das Sprechen und die Artikulation fallen immer schwerer bis hin zur Unfähigkeit, verbal zu kommunizieren. In diesem Fall können Kommunikationshilfen notwendig werden.
Schluckstörung (Dysphagie)
Die Schluckstörung beginnt meist mit einer leichten Schwäche oder Steifigkeit der Zungen- und Schlundmuskulatur. Im weiteren Krankheitsverlauf nimmt die Beweglichkeit der Muskulatur ab. Bei einer hochgradigen Schluckstörung ist die Kau- und Schluckmuskulatur schwer oder vollständig gelähmt und das Schlucken von Nahrung kaum oder nicht mehr möglich. Sehr fest oder dünnflüssige Nahrungsmittel bereiten Schwierigkeiten. Eine spezielle Nahrungszusammenstellung oder Ernährungshilfen werden notwendig, um einem Gewichtsverlust entgegen zu wirken.
Atemfunktionsstörung
Die Einschränkung der Atemfunktion entsteht durch eine Schwäche der Atemmuskulatur am Brustkorb und des Zwerchfells. Je nach Krankheitsverlauf können verschiedene Atemhilfen genutzt werden. In Deutschland wird bei etwa 30 % aller Patienten eine Maskenbeatmung und bei bis zu 10 % eine invasive Beatmung mit Luftröhrenschnitt eingesetzt.
Diagnosestellung
Die wesentlichen Hinweise für eine ALS ergeben sich bereits durch eine körperliche Untersuchung. Neurologisch ausgebildete Ärzte sind in der Lage, ALS-typische Symptome festzustellen. Typischerweise liegen bei ALS-Patienten keine Gefühlsstörung, Nervenschmerzen oder geistigen Einschränkungen vor.
Ein weiteres Merkmal der ALS-Symptomatik ist die langsame Zunahme der Muskelschwäche oder Steifigkeit. Wenn die schmerzlosen Lähmungen schleichend beginnen und allmählich fortschreiten, ohne dass andere neurologische Beschwerden auftreten, entsteht der Verdacht auf ALS. Die äußerlich erkennbaren Symptome können durch zusätzliche Diagnoseverfahren bestätigt und gemessen werden (Elektromyographie, Elektroneurographie, motorisch-evozierte Potentiale).
Ausschluss von Krankheiten mit ähnlichen Symptomen
Einige sehr seltene Erkrankungen können ALS-ähnliche Symptome aufweisen. Zu ihnen zählen eine mechanische Schädigung des Rückenmarks (zervikale Myelopathie), Muskelerkrankungen (z.B. Einschlusskörperchenmyopathie), Erkrankungen der peripheren Nerven (motorische Polyneuropathie), bestimmte Formen der Multiplen Sklerose, neurologische Folgeerkrankungen durch Tumore (paraneoplastische Syndrome) und sehr seltene Stoffwechselerkrankungen. Um diese Erkrankungen nachzuweisen oder auszuschließen, stehen verschiedene Untersuchungsmethoden zur Verfügung: Magnetresonanztomographie (Tumor- oder Entzündungserkrankungen des Gehirns und Rückenmarks), Nervenwasseruntersuchung (Infektionen und Autoimmunerkrankungen) oder spezifische Blutuntersuchungen (Stoffwechselerkrankungen, Autoimmunerkrankungen und bestimmte Tumorerkrankungen).
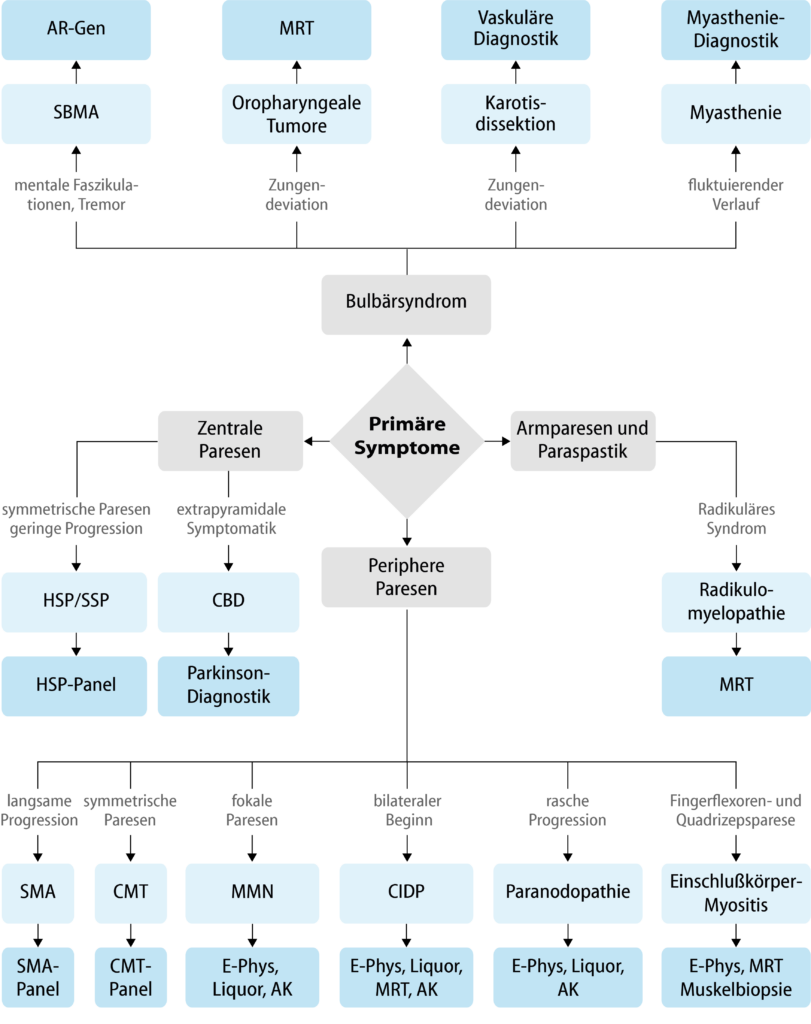
Obwohl die ALS-ähnlichen Erkrankungen sehr selten sind, werden die Untersuchungsverfahren der Zusatz- und Ausschlussdiagnostik mehrheitlich eingesetzt, um eine größtmögliche diagnostische Sicherheit zu erlangen. Bei einem Teil der Betroffenen kann der körperliche Untersuchungsbefund so aussagekräftig sein, dass die klinischen Kriterien einer ALS auch ohne Zusatz- und Ausschlussdiagnostik vorliegen. In diesem Fall kann auf die genannten Untersuchungsverfahren verzichtet werden.
Genetische Diagnostik
Allen Betroffenen ist eine genetische Diagnostik anzubieten. Die häufigsten Mutationen (14% aller Patienten) finden sich in den Genen C9orf72, SOD1, FUS und TARDBP („Core Panel“). Mutationen in SOD1 (Tofersen-Therapie) und FUS (laufende Phase 3-Studie) sind therapeutisch relevant. Bei C9orf72– und TARDBP-assoziierter ALS sind Studien in Vorbereitung. Bei spezifischen Fragestellungen, insbesondere der familiären ALS, kann eine erweiterte Panel-Diagnostik notwendig werden.
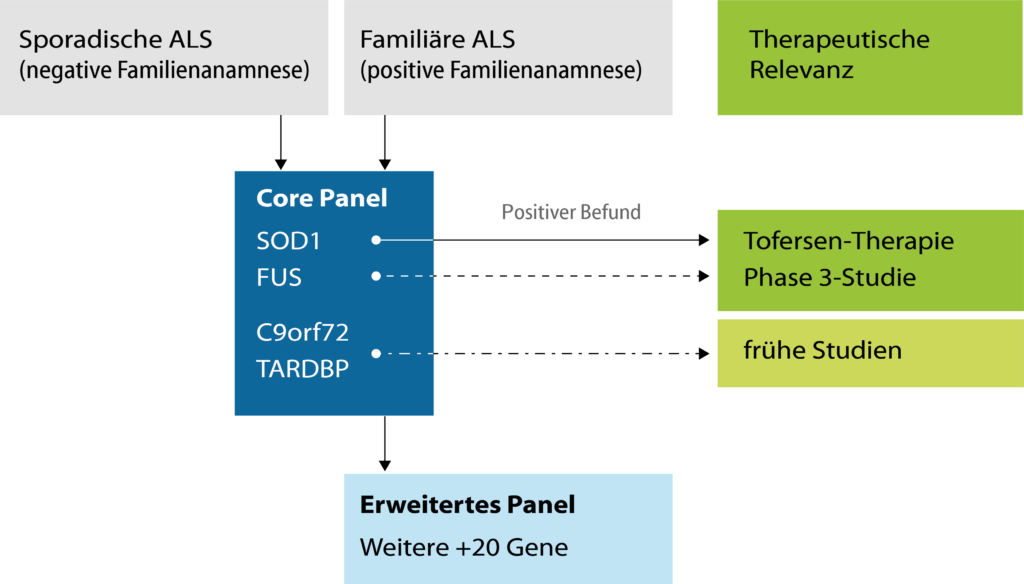
Die genetische Diagnostik ist in Deutschland grundsätzlich möglich. Zwischen Versicherten der gesetzlichen (GKV) und privaten Krankenversicherung (PKV) bestehen wichtige Unterschiede. Bei gesetzlich Versicherten ist die Überweisung von einem Vertragsarzt (Hausarzt oder niedergelassenen Neurologen) zur genetischen Testung möglich. Bei Patienten mit einer privaten Krankenversicherung ist vor der Einleitung der Diagnostik ein Angebot vom genetischen Labor einzuholen und der PKV vorzulegen.
Genetische Beratung
Grundsätzlich ist zwischen einer genetischen Beratung (durch einen Facharzt für Humangenetik) und der technischen Durchführung der genetischen Analyse (überwiegend Fachärzte für Labormedizin) zu differenzieren. Bei der ALS ist eine genetische Beratung von entscheidender Bedeutung, da der Nachweis von Mutationen auch für die genetische Verwandten von Bedeutung sein kann. Bei der genetischen Beratung ist eine Spezialisierung zur ALS hilfreich und sinnvoll. Nur wenige Fachärzte für Humangenetik sind in Deutschland zur ALS spezialisiert. Daher wurde das ALS-Genetikprogramm geschaffen, um den Kontakt (und die Beratung) in einem spezialisierten Zentrum für Humangenetik zu erreichen.
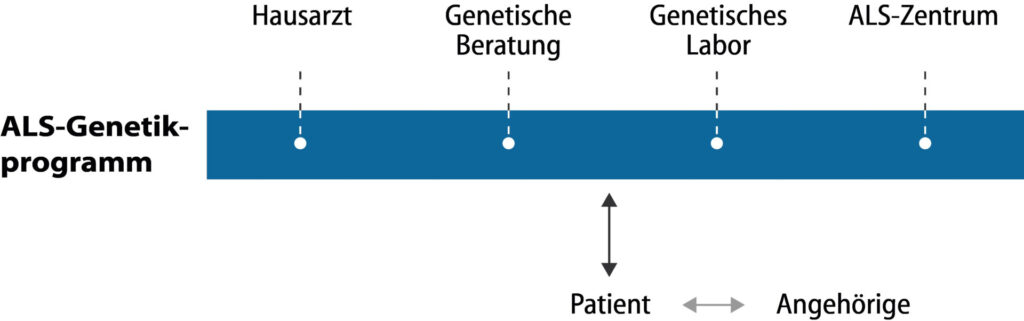
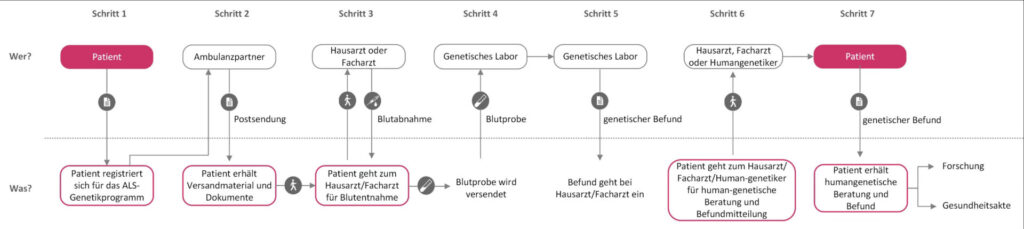
Das ALS-Genetikprogramm von Ambulanzpartner ist ein Angebot, um die notwendigen Kontakte (Zentrum für Humangenetik mit Erfahrung zur ALS) herzustellen und formalen Voraussetzungen der dortigen Beratung und Testung zu schaffen (notwendige Angaben auf der Laboranforderung, Überweisungsträger und Dokument zur Festlegung der genetischen Information).
Genetische Beratung von Verwandten
Eine genetische Beratung für Angehörige von Menschen mit ALS ist vor allem dann sinnvoll, wenn eine familiäre ALS (F-ALS) oder eine genetische ALS mit nachgewiesener Mutation vorliegt. Die Beratung trägt dazu bei, das individuelle Risiko für andere Familienmitglieder einzuschätzen und informiert über genetische Diagnostik, mögliche Ergebnisse und deren Konsequenzen. Sie kann besonders relevant für direkte Verwandte sein (insbesondere Geschwister oder Kinder), da diese ein erhöhtes Risiko für das Vorliegen einer Mutation haben könnten. Wichtig ist jedoch, dass die Entscheidung für oder gegen eine genetische Diagnostik gut abgewogen wird, da das Ergebnis psychische und soziale Auswirkungen haben kann. Daher können die genetische Beratung, Diagnostik und Mitteilung von Untersuchungsergebnissen von asymptomatischen Personen (Verwandte ohne Anzeichen einer ALS) nur durch Fachärzte für Humangenetik oder einer anderen besonderen humangenetischen Qualifikation durchgeführt werden. Über das ALS-Genetikprogramm kann der Kontakt zu genetischen Spezialisten hergestellt werden.
Beratung von asymptomatischen Genträgern
Ein asymptomatischer Genträger ist eine Person, die eine genetische Veränderung (Mutation) in einem der bekannten ALS-Gene trägt, jedoch keine Krankheitszeichen (Symptome) aufweist. Solche Personen haben ein erhöhtes Risiko, im Laufe ihres Lebens eine ALS zu entwickeln, während das tatsächliche Risiko vom jeweiligen Gen und der Art der Mutation abhängt. Bei nicht allen Genträger kommt die ALS zum Ausbruch, da auch andere Faktoren, wie Umwelteinflüsse und individuelle genetische Variationen, eine Rolle spielen. Eine genetische Beratung ist für asymptomatische Genträger wichtig, um über das Risiko, mögliche Frühzeichen einer ALS sowie über mögliche psychologische sowie soziale Auswirkungen informiert zu werden. Dazu empfiehlt sich die Vorstellung in einem Medizinischen Versorgungszentrum oder Institut für Humangenetik, das zur ALS-Genetik spezialisiert ist.
Kontrolluntersuchungen bei asymptomatischen Genträgern
Durch eine neurologische Untersuchung in größeren Abständen können mögliche frühe Anzeichen einer ALS identifiziert werden. Richtlinien über den geeigneten zeitlichen Abstand und zur Testung des Biomarkers Neurofilament (NfL) sind noch nicht verabschiedet worden. Für asymptomatische Genträger mit SOD1-Mutation ist eine neurologische Untersuchung und NfL-Analyse im Abstand von zwölf Monaten zu empfehlen. Bei diesen Kontrollen steht die Frage nach Frühzeichen der ALS im Vordergrund, die als prodromale ALS bezeichnet werden. Bereits bei Frühzeichen einer ALS kann die Therapie mit Tofersen eingeleitet werden. Damit hat die Kontrolluntersuchung bei asymptomatischen Genträgern einer SOD1-Mutation eine therapeutische Relevanz und den Status einer Vorsorgeuntersuchung. In einigen Fällen besteht die Möglichkeit, an Forschungsprojekten teilzunehmen, die auf Präventions- und Früherkennungsstrategien abzielen.
Verlauf
Die ALS verläuft bei jedem Patienten unterschiedlich. Der individuelle Krankheitsverlauf ist davon geprägt, in welcher Muskelgruppe die Symptome auftreten.

Mobilitätseinschränkungen
Durch Muskelschwund und Steifigkeit wird die betroffene Extremität fortschreitend gelähmt. Sind zuerst die untern Extremitäten (Beine und Füße) betroffen, bedeutet dies eine zunehmende Gehstörung bis hin zur Notwendigkeit einer Gehstütze oder eines Rollstuhls. Bei den oberen Extremitäten werden das Heben, Tragen, Schreiben, Schneiden, Essen und die Körperpflege fortschreitend beeinträchtigt.
Sprech- und Schluckstörung
Bei 30 % der Betroffenen entstehen eine Sprech- und Schluckstörung (“bulbäre Symptome”) im frühen Krankheitsverlauf, während bei der Mehrheit der Betroffenen die Sprech- und Schluckstörung im späteren Verlauf – zusätzlich zur Schwäche an den Extremitäten – auftreten. Etwa 80 % aller Menschen mit ALS erfahren im Krankheitsverlauf eine Schluckstörung.
Atemfunktionsstörung
Je nach Krankheitsverlauf können verschiedene Atemhilfen genutzt werden. In Deutschland wird bei etwa 30 % aller Patienten eine Maskenbeatmung und bei bis zu 10 % eine invasive Beatmung mit Luftröhrenschnitt eingesetzt.
Prognose
Prognosefaktoren
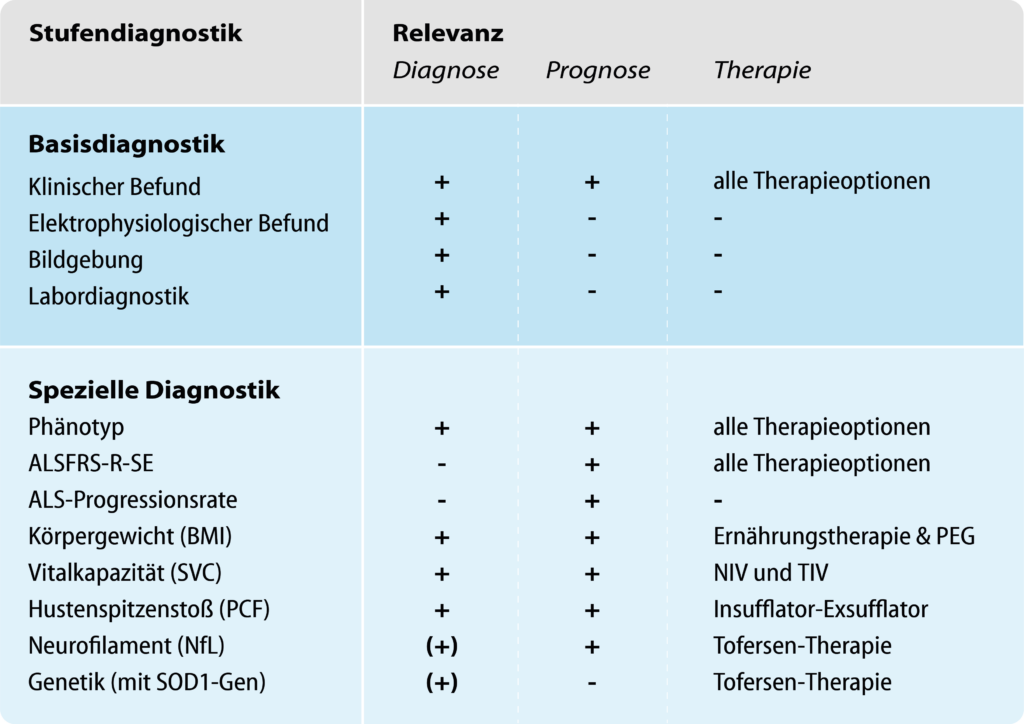
Die Progression der Symptome und damit verbundene Prognose sind individuell sehr unterschiedlich. Durch eine fortschreitende Mangelernährung (Schluckstörung) oder durch eine respiratorische Insuffizienz (neuromuskuläre Hypoventilation) führt die ALS zu einer Lebensverkürzung. Die Überlebensprognose wird jedoch von zahlreichen Faktoren bestimmt – die Überlebenszeit ist daher individuell und entzieht sich einer Verallgemeinerung. Der Schweregrad der Symptome und die ALS-Progressionsrate (ALSPR) werden durch die ALS-Funktionsskala (ALSFRS-R) ermittelt – eine Fremd- und Selbstbewertungsskala, die durch Ärzte, Patienten und Angehörige über den ausgedruckten Fragebogen sowie über die ALS-App erhoben werden kann. Die Messung der Vitalkapazität (SVC, slow vital capacity), des Spitzenhustenstoßes (PCF, peak cough flow) und des Body Mass Index (BMI) dient der Entscheidungsfindung für eine Beatmungs- und Ernährungstherapie oder eine palliative Behandlung. Der Biomarkers Neurofilament light chain (NfL) korreliert mit der ALS-Progression und trägt ebenfalls zur Abschätzung der Prognose bei.
Lebenszeit
Die mittlere zu erwartende Lebenszeit von Menschen mit ALS beträgt nach der Diagnosestellung 3 bis 5 Jahre. Etwa 10 % haben einen langsamen Verlauf der ALS mit längeren Überlebenszeiten. Bei einem Teil der Patienten sind Verläufe von mehr als 10 Jahren bekannt. Die statistischen Angaben beziehen sich auf den Krankheitsverlauf ohne Berücksichtigung von modernen Behandlungsoptionen. Durch die Nutzung von Atemhilfen (Maskenatmung, invasive Beatmung) und Ernährungshilfen (Trinknahrung, Ernährungssonde) kann eine Lebenszeitverlängerung von wenigen Monaten bis hin zu vielen Jahren erreicht werden, abhängig von den eingesetzten Behandlungsverfahren und vom individuellen Krankheitsverlauf. Die Prognose der Erkrankung wird von verschiedenen Faktoren bestimmt, die komplex sind und in der Gesamtheit betrachtet werden müssen.
ALS-Progressionsrate (ALSPR)
Ermittlung der ALS-Progressionsrate (ALSPR)
Die ALS-Progressionsrate (ALSPR) gibt an, wie schnell die motorischen Symptome und funktionellen Defizite bei Patienten mit ALS fortschreiten.

Wege zur ALS-Progressionsrate (ALSPR)
Die ALS-Progressionsrate (ALSPR) wird in spezialisierten Ambulanzen oder Schwerpunktpraxen ermittelt, die auf die Diagnostik und Therapie der ALS ausgerichtet sind. Dort wird die ALS-Funktionsskala (ALSFRS-R) von Fachpersonal wie Neurologen, Study Nurses oder Medizinischen Fachangestellten erhoben. Auf Grundlage der Skalenwerte wird anschließend die ALSPR berechnet. Diese Information wird in der medizinischen Dokumentation festgehalten und in Arztbriefen für die Patientenperspektive zugänglich gemacht. Die ALSPR hat auch eine wichtige Bedeutung in der Forschung. In klinischen Studien, insbesondere bei der Prüfung neuer Medikamente, ist sie ein fester Bestandteil des Studienprotokolls und wird bei jeder Studienvisite erhoben und dokumentiert. Patienten können ihre ALS-Progressionsrate auch eigenständig bestimmen, indem sie die ALS-Funktionsskala über die ALS-App ausfüllen. Voraussetzung ist die Angabe des Symptombeginns (Monat und Jahr), der in der App dokumentiert wird. Die App berechnet dann automatisch die ALSPR und zeigt sie auf der Startseite an.
“Grundprogression” der ALS
Die Progressionsrate der ALS (ALSPR) bleibt im Krankheitsverlauf relativ konstant. Bei einer langsameren Progression kommt es nur selten zu einer plötzlichen Beschleunigung, ebenso wie eine deutliche Verlangsamung bei schnellerem Verlauf ungewöhnlich ist.
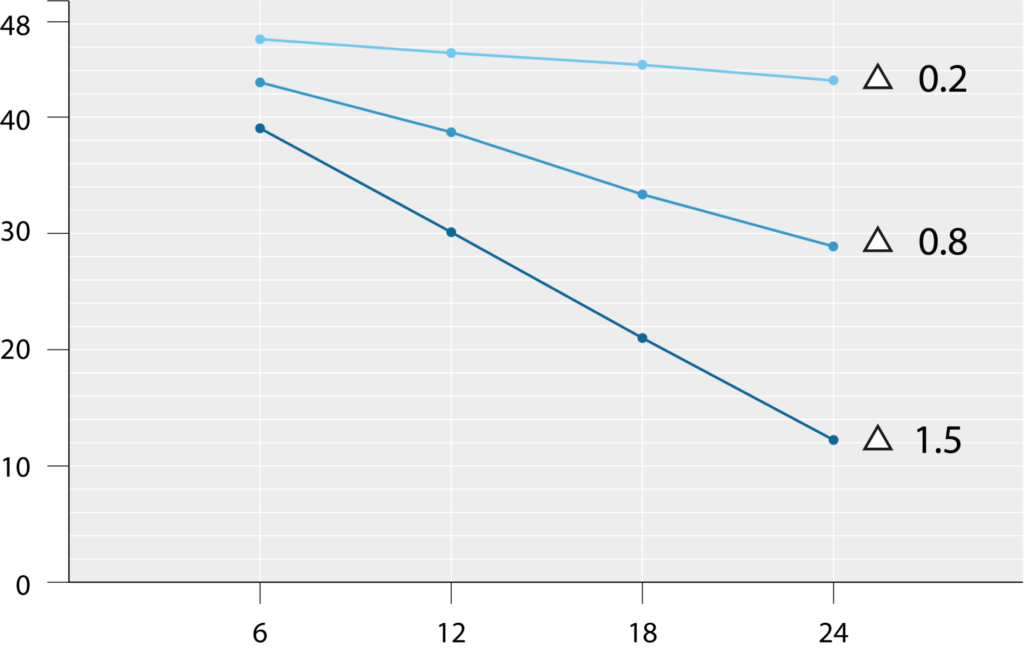
ALS-Phänotypen
Die ALS ist eine komplexe und individuell verlaufende Erkrankung, bei der sich die Symptome und deren zeitlicher Verlauf stark unterscheiden. Diese „Heterogenität“ (Unterschiedlichkeit) ist ein zentrales Merkmal der Krankheit und stellte sich in unterschiedlichen Varianten und besonderen Verläufen dar, die als „Phänotypen“ bezeichnet werden. „Phänotyp“ ist ein medizinisches Wort aus dem Griechischen, das sich wie folgt umschreiben lässt: Erscheinungsbild einer Erkrankung, Symptommuster oder Krankheitsausprägung. Bei der ALS wird der Phänotyp von drei Faktoren bestimmt: 1) Ort des Symptombeginns – die ALS kann in verschiedenen Körperregionen beginnen, an der Sprech- und Schluckmuskulatur, den Armen, Beinen oder der Atemmuskulatur; 2) die Propagation („Ausbreitung“) – die Geschwindigkeit und Richtung, in der sich die motorischen Symptome vom Ausgangsort auf andere Körperregionen ausbreiten; und 3) das Ausmaß der Motoneuron-Symptome – die ALS kann das erste Motoneuron (1.MN) und/oder das zweite Motoneuron (2. MN) unterschiedlich stark betreffen. Diese Unterschiede im Phänotyp beeinflussen die Reihenfolge der Symptome sowie die Progression und auch die Überlebenszeit. Einige Formen der ALS schreiten langsamer voran, während andere eine raschere Progression zeigen. Daher ist die genaue Bestimmung des klinischen Phänotyps für die individuelle Prognose, die Planung von Therapien und die Teilnahme an klinischen Studien von großer Bedeutung.
Bedeutung der Phänotypen für die Prognose
Die ALS-Phänotypen können mit unterschiedlicher ALS-Progressionsrate (ALSPR) und auch Überlebenszeit verbunden sein. So sind Phänotypen mit einem Beginn an den Beinen, mit einer langsamen Propagation sowie mit einer ausschließlichen Beteiligung des ersten oder zweiten Motoneurons mit einer günstigeren Prognose verbunden. Damit können die Phänotypen dazu beitragen, die Prognose im zu erwartenden Verlauf weiter zu individualisieren und andere etablierte Prognosefaktoren wie die ALS-Progressionsrate, Neurofilament, Body-Mass-Index oder Atmungsparameter zu ergänzen. Weiterhin werden Phänotypen in klinischen Studien bestimmt, um die klinische Heterogenität von Studiengruppen zu verringern oder die Medikamentenentwicklung auf bestimmte Phänotypen auszurichten. Zu betonen ist, dass die Phänotypen steht im Zusammenhang mit anderen Prognosefaktoren gewertet und abgewogen werden müssen.
OPM-Klassifikation
Bei der ALS wird der Phänotyp von drei anatomischen Faktoren bestimmt: 1) Ort des Symptombeginns („O“), 2) das Propagationsmuster („P“) mit der sich die motorischen Symptome vom Ausgangsort auf andere Körperregionen ausbreiten; und 3) das Ausmaß der Motoneuron-Symptome („M“), da die ALS das erste Motoneuron (1.MN) und/oder das zweite Motoneuron (2. MN) unterschiedlich stark betreffen kann. Für jeden Patienten lassen sich die drei Faktoren individuell bestimmen. Die Phänotyp-Bestimmung nach Ort des Symptombeginns („O“), Propagationsmuster („P“) und Motoneuron-Symptomen („M“) wird als „OPM-Klassifikation“ bezeichnet. Die OPM-Klassifikation ist für die Ermittlung der individuellen Prognose von Bedeutung.
Phänotypen nach Ort des Symptombeginns
Der Symptombeginn wird durch eine Schwäche oder/und verlangsamte, unkoordinierte Bewegungen and Arm oder Bein oder eine Sprech- und/oder Schluckstörung oder eine Atemschwäche (Hypoventilation) definiert.

Phänotypen der Propagation
Die Propagation (Ausbreitung) beschreibt das zeitliche und räumliche Muster, in dem sich die motorischen Symptome von der Region des Symptombeginns auf eine andere Körperregion (zum Beispiel von den Armen auf die Beine oder auf die Muskulatur des Kopfes) ausbreitet. Die Ermittlung der Propagation basiert auf der Krankengeschichte (Anamnese) und/oder neurologischen körperlichen Untersuchungen in einem Verlauf von mindestens 12 Monaten.

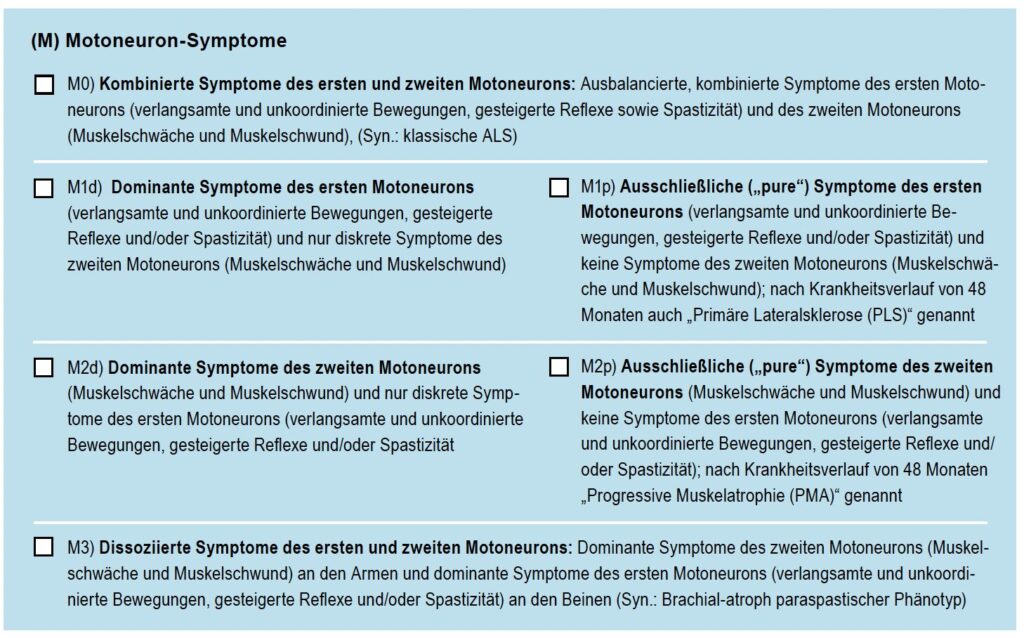
Phänotypen der Motoneuron-Symptome
Symptome des ersten Motoneurons (1. MN) sind verlangsamte und unkoordinierte Bewegungen, gesteigerte Reflexe sowie Spastizität. Zu den wichtigsten Symptomen des zweiten Motoneurons gehören Muskelschwäche (Paresen) und Muskelschwund (Atrophie).