Grundsätzliches
Für die ALS ist bisher keine Heilung möglich. Durch zahlreiche Behandlungsformen können jedoch die Lebenszeit verlängert, Symptome gelindert und die Teilhabe verbessert werden.
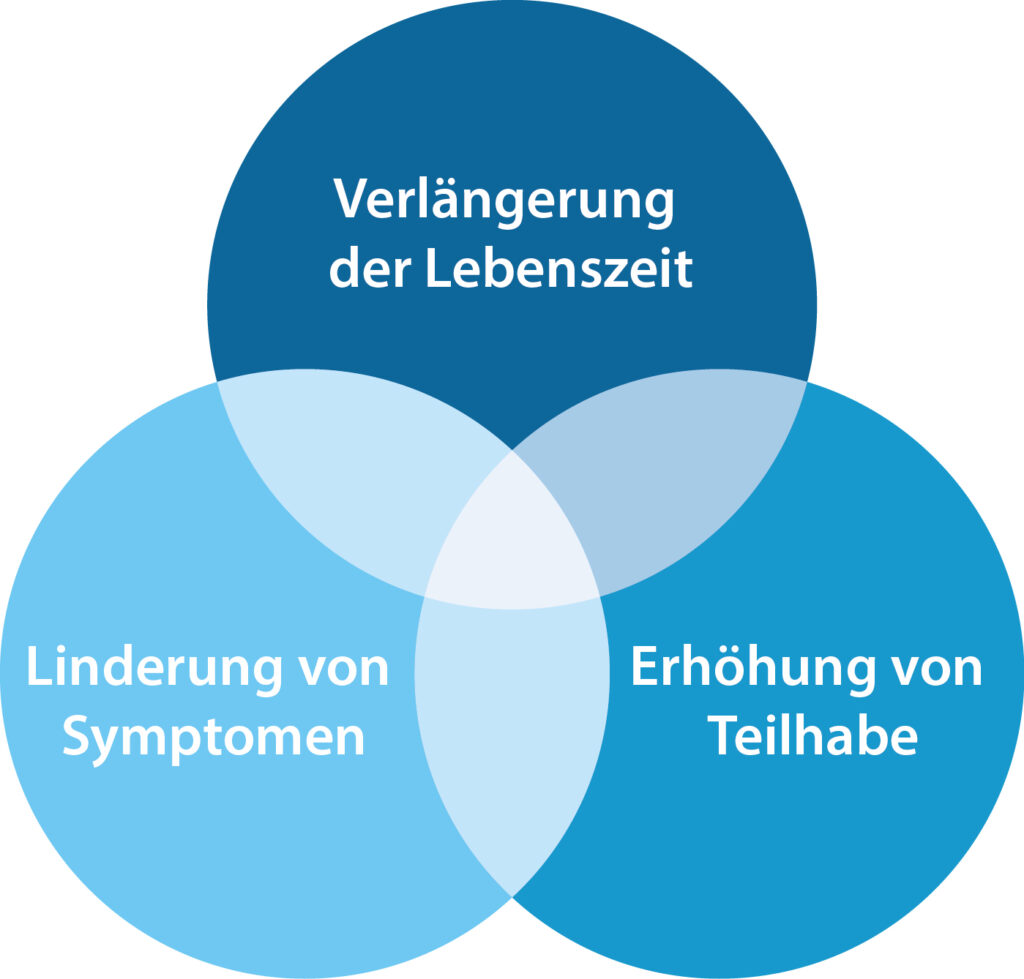
Eine Erhöhung der Lebenszeit ist durch das Medikament Riluzol, den gezielten Einsatz von Atemhilfen sowie eine spezifische Ernährungstherapie möglich.
Medikamente
Riluzol – das Basismedikament
Riluzol ist das Basismedikament, das zweimal täglich eingenommen wird, und den Krankheitsverlauf moderat verlangsamen kann.
Eine Verbesserung der bestehenden Symptome ist nicht zu erwarten. Die Substanz zielt auf eine Verringerung der Ausbreitungsgeschwindigkeit der motorischen Symptome (Reduktion der ALS-Progression).
Riluzol ist eine pharmakologische Substanz, die den Botenstoff Glutamat im Gehirn und Rückenmark reduziert. In der ALS-Forschung wurde nachgewiesen, dass Glutamat in den Synapsen des motorischen Nervensystems in toxischer Konzentration auftritt und zu einer Schädigung der Motoneurone beiträgt (Hypothese der „Glutamattoxizität“ bei der ALS). An dieser Stelle setzt Riluzol an: das Medikament entfernt überschüssiges Glutamat aus dem synaptischen Spalt, der Verbindungsstelle zwischen motorischen Nervenzellen. Mit der Absenkung der Glutamatkonzentration durch Riluzol wird die schädigende Wirkung vom synaptischen Glutamat reduziert.
Riluzol ist bereits Anfang der 1990er-Jahre von einem französischen Arzneimittelunternehmen entwickelt worden und seit 1995 in Deutschland (Europa, den USA und zahlreichen anderen Ländern) zugelassen. Riluzol ist das Basismedikament zur Behandlung der ALS. In der Zulassungsstudie Anfang der 1990er-Jahre konnte gezeigt werden, dass Riluzol das Überleben bei der ALS verlängert. Der mittlere Lebenszeitgewinn in der Zulassungsstudie betrug 82 Tage, jedoch wurden die Patienten erst spät im Krankheitsverlauf mit Riluzol behandelt (2,2 Jahre nach Symptombeginn). Die heutige klinische Praxis sieht eine frühere Behandlung vor. Neuere Studien gehen von einem größeren Überlebensvorteil aus, wenn die Therapie möglichst zeitig begonnen wird. Vor diesem Hintergrund ist Riluzol als Basismedikation mit einer guten Verträglichkeit zu betrachten.
Riluzol – Verträglichkeit
Auf Grund der langen Behandlungserfahrung seit über 25 Jahren sind die Wirkungen und mögliche Nebenwirkungen gut bekannt. Insgesamt ist Riluzol als gut verträgliches Medikament zu betrachten.
Nebenwirkungen (Unwohlsein, Übelkeit, Hautveränderungen u.a.) treten nur im Ausnahmefall und dann vor allem am Anfang der Medikation auf.
Riluzol ist ein pharmakologischer „Glutamatsenker“. Die Konzentration von Glutamat wird sehr gezielt – an den Synapsen im Gehirn und Rückenmark – reduziert. Wichtig ist, dass die Glutamatkonzentration in den Synapsen vollständig vom Glutamat im sonstigen Körper getrennt und unabhängig von der Nahrungsaufnahme ist. Daher muss keine „Glutamat-Diät“ eingehalten werden – im Gegenteil: eine vollwertige Ernährung mit allen Nahrungsbestandteilen ist von großer Bedeutung.
Im Fall von Nebenwirkungen bei Therapiebeginn ist eine reduzierte Dosis und eine langsame Dosissteigerung empfehlenswert. Diese veränderte Dosierung ist mit dem ALS-Zentrum (oder Facharztpraxis) oder dem Apotheker abzusprechen. Bei Therapiebeginn – und auch im weiteren Behandlungsverlauf – ist die Beratung und Begleitung durch eine spezialisierte ALS-Apotheke möglich und zu empfehlen (ALS-Apothekenprogramm).
Riluzol – Filmtablette, Schmelzfilm oder Suspension
Es wird zwei Mal täglich (morgens und abends) eingenommen. Jede Tablette enthält 50 mg. Die Gesamtdosis beträgt 100 mg pro Tag (zwei Filmtabletten). Bei einer Schluckstörung stehen besonders entwickelte Darreichungsformen zur Verfügung – der Riluzol-Schmelzfilm (EMYLIF) und die Riluzol-Suspension (Teglutik).
Der Riluzol-Schmelzfilm (EMYLIF) ist ein kleines und dünnes Plättchen, das auf die Zunge, den Gaumen oder die Mundschleimhaut gelegt wird.
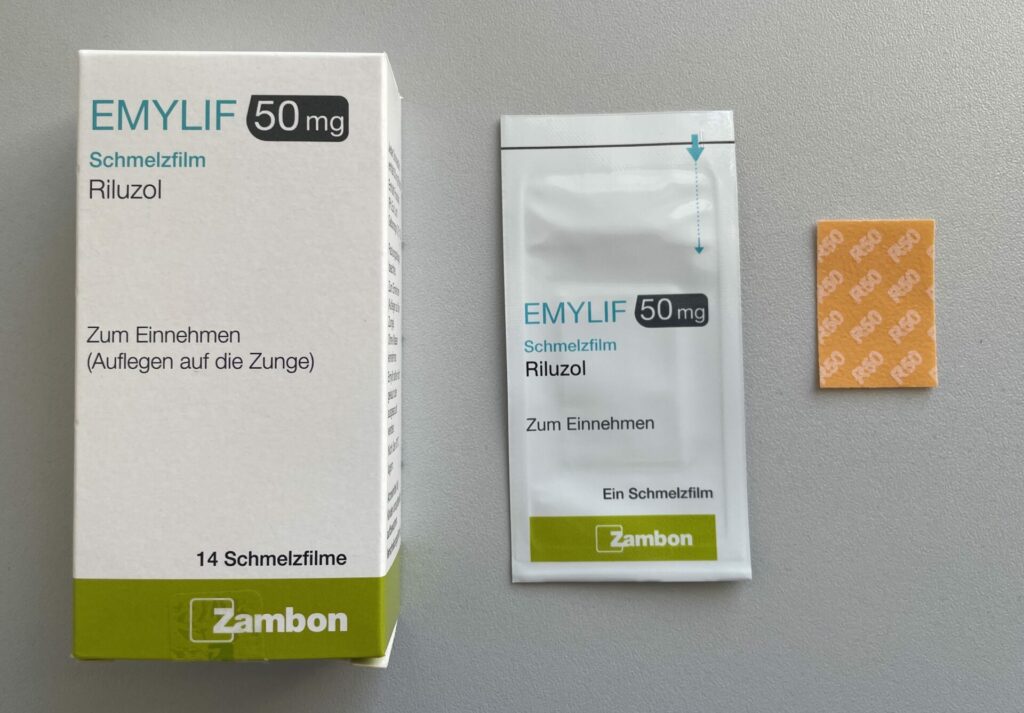
Dort bleibt das Plättchen haften und löst sich sofort auf. Das in dem Schmelzfilm enthaltene Riluzol wird unmittelbar vom Speichel aufgenommen und kann sehr einfach geschluckt werden. Auch diese Schmerztablette wird zweimal täglich eingenommen. Jede Schmerztablette enthält 50 mg Riluzol. Dieser Schmelzfilm ist das geeignete Riluzol, wenn die Schluckfunktion verändert ist und/oder Schwierigkeiten der Tabletteneinnahme bestehen. Eine typische Nebenwirkung ist ein vorübergehendes Taubheitsgefühl im Mund, das mit dem anästhetischen Gefühl nach einem Zahnarztbesuch vergleichbar ist. Der Effekt ist individuell sehr unterschiedlich, hält wenige Minuten (bis 1 Stunde) an und ist in jedem Fall als unkritisch zu betrachten.
Die Riluzol-Suspension (Teglutik) ist eine Flüssigkeit mit der Konsistenz eines „Nektars“ und in einer Flasche zur Verfügung gestellt wird.

Die Einnahme der Suspension ist zu empfehlen, wenn eine hochgradige Schluckstörung vorliegt oder eine Ernährungssonde (PEG) vorhanden ist. Im Fall einer PEG ist von einer Zerkleinerung von Filmtabletten („Zermörsern“) abzuraten, da die PEG-Sonde geschädigt und auch die vollständige Aufnahme der notwendigen Dosis von Riluzol nicht gewährleisten werden kann. Daher ist bei einer PEG die Riluzol-Suspension die geeignete und etablierte Darreichungsform. Auch die Riluzol-Suspension wird zweimal täglich eingenommen. Dabei werden 10 ml der Lösung morgens und abends aus der Flasche entnommen und „per os“ (über den Mund) aufgenommen oder über die PEG appliziert. 10 ml der Suspension enthalten 50 mg Riluzol. Bei der Aufnahme über den Mund kann (wie beim Schmelzfilm) ein vorübergehendes Taubheitsgefühl im Mund entstehen, das mit dem anästhetischen Gefühl nach einem Zahnarztbesuch vergleichbar ist. Der Effekt ist individuell sehr unterschiedlich, hält wenige Minuten (bis 1 Stunde) an und ist in jedem Fall als unkritisch zu betrachten. Bei einer Aufnahme des Medikamentes über die PEG ist dieser Effekt nicht zu erwarten.
Riluzol-Programm: das geeignete Riluzol bestimmen
Mit der Filmtablette, dem Schmelzfilm und einer Suspension sind 3 Riluzol-Darreichungsformen vorhanden, deren Anwendung individuell entschieden und im gesamten Krankheitsverlauf überprüft werden sollte.

Die Entscheidung für das geeignete Riluzol ist recht komplex und wird maßgeblich von der Schluckfunktion und dem Vorliegen einer PEG bestimmt.
Durch die Selbstbewertung der ALSFRS-R-SE über die ALS-App können Patienten ihre ALS-bezogenen Symptome (so auch zum Schlucken und Speichelfluss) auf strukturierte Weise mitteilen. Die Ergebnisse der ALSFRS-R-SE-Selbstbewertung können von geschulten Koordinatorinnen im Ambulanzpartner-Versorgungsnetzwerk sowie von ALS-Apotheken eingesehen werden. Bei Vorliegen einer Schluckstörung (oder einer PEG) können sowohl Apotheken als auch Koordinatorinnen eine Empfehlung für die Umstellung der Riluzol-Medikation auf den Schmelzfilm oder die Suspension geben. Die abschließende Entscheidung liegt beim Arzt. Das Zusammenwirken von ALS-Apothekern, ALS-Koordinatorinnen, den Betroffenen und dem Arzt wird als Riluzol-Programm bezeichnet. Dieses Programm ist ein Angebot im Ambulanzpartner-Versorgungsnetzwerk und ein Bestandteil des ALS-Apothekenprogramms. Das Riluzol-Programm hat die folgenden Inhalte:
- Erfassung von Schwierigkeiten der Medikamenteneinnahme durch ALS-Apotheke
- Erfassung von Frage 3 & 2 der ALSFRS-Funktionsskala (Schlucken & Speichelfluss) durch ALS-Apotheke
- Empfehlung der Medikamentenumstellung (z.B. auf Schmelzfilm oder Suspension) durch ALS-Apotheke an Arzt (wenn notwendig)
- monatliche Selbstbewertung zum Schlucken & Speichelfluss) über ALS-App (optional, bei Teilnahme an ALS-App)
- Rücksprache von ALS-Apotheke mit Patienten oder Angehörigen zur Schluckstörung oder Anlage einer PEG sowie Empfehlung der Medikamentenumstellung durch ALS-Apotheke an Arzt (wenn notwendig)
Tofersen – genetische Therapie bei der SOD1-ALS
Abb. Tofersen (Qualsody) ist ein Medikament zur Injektion
Etwa 2,5 % aller Menschen mit ALS liegen genetische Veränderungen im Gen der Superoxiddismutase 1 (SOD1) vor. Die Mutationen im SOD1-Gen sind bei diesen Patienten für die ALS verantwortlich sind. Die schädlichen Auswirkungen der Mutationen im SOD1-Gen können durch das genetisches Medikament Tofersen (Handelsname Qualsody) reduziert werden.
Tofersen ist ein Wirkstoff aus der Gruppe der Antisense-Oligonukleotide (ASO). Tofersen ist in Deutschland bereits seit Anfang 2022 in einem Härtefallprogramm verfügbar und seitdem an der Charité und anderen spezialisierten ALS-Zentren in Anwendung. Die bisherigen Erfahrungen zeigen eine sehr gute Verträglichkeit und eine Wirksamkeit bei der Mehrheit der Betroffenen. Die Wirkung zeigt sich in einer Verlangsamung oder einem Stillstand der ALS. Bei einzelnen Patienten zeigte sich eine Verbesserung von motorischen Funktionen.
Abb. Tofersen-Therapie: Die Tofersen-Behandlung erfolgt durch eine Lumbalpunktion. Die Behandlung erfordert eine wiederholte Gabe des Medikamentes mit einer Injektion im Abstand von einem Monat. Die Therapie wird ambulant durchgeführt und allgemein gut vertragen.
Die ALS-Ambulanz der Charité ist auf die Behandlung mit Tofersen spezialisiert. Anfragen zur Behandlung sind an den folgenden Kontakt zu richten: als-ambulanz@charite.de
Bundesweit bieten ausgewählte Ambulanzen und Schwerpunktpraxis die Behandlung mit Tofersen an. Die Koordinatorinnen von Ambulanzpartner unterstützen bei der Überleitung zur Tofersen-Therapie: koordination@ambulanzpartner.de
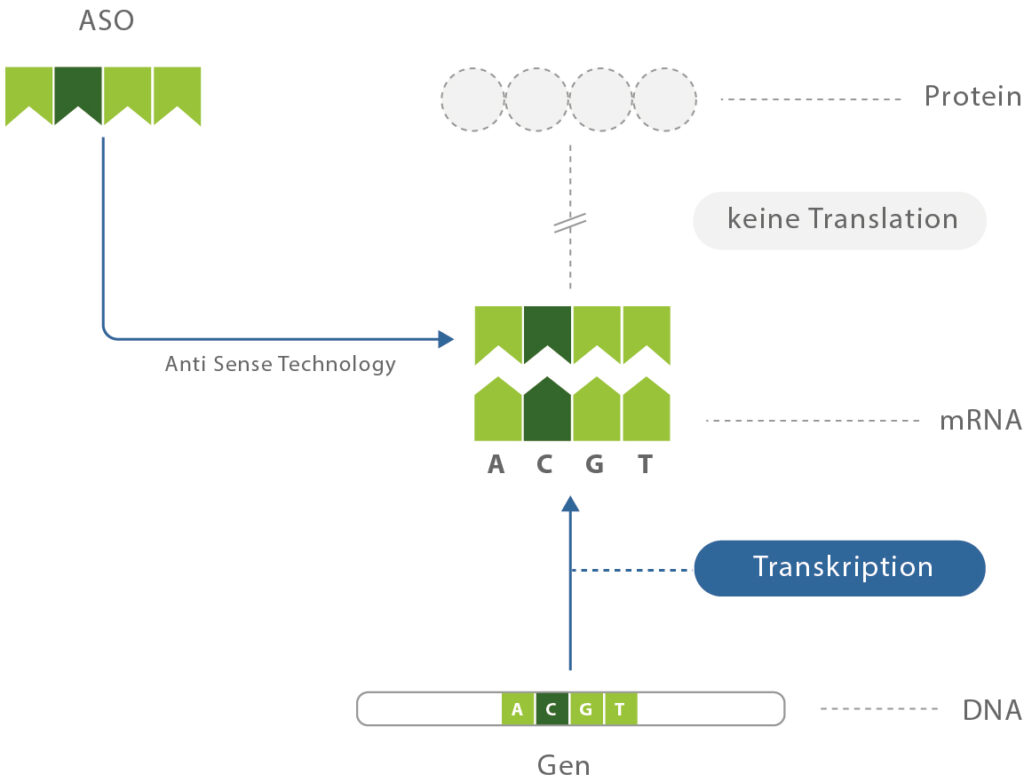
Abb. Wirkprinzip der Antisense-Oligonukleotide (ASO). Bei den ASO handelt es sich um synthetische DNA, die den zellulären Prozess vom genetischen Material (Genom), über die Boten-RNA (Transkription) bis zur Synthese eines Eiweißes (Translation) therapeutisch beeinflussen kann. Tofersen unterbricht den Weg von der SOD1-Gen-Mutation bis zur Bildung eines schädlichen (toxischen) SOD1-Eiweißes.
Die Tofersen-Therapie beruht auf den Ergebnissen einer klinischen Studie mit Tofersen (VALOR-Studie), die im November 2021 abgeschlossen wurde. In dieser Studie konnten verschiedene Verbesserungen im Krankheitsverlauf nachgewiesen werden (deutliche Reduktion des Biomarkers NfL, Verlangsamung der Erkrankung anhand der ALS-Funktionsskala, positive Beeinflussung der Atemfunktion). Die positiven Ergebnisse aus der Zulassungsstudie konnte durch die Therapieforschung in Deutschland bestätigt und erweitert werden.
Publikationen:
- Zulassungsstudie: https://pubmed.ncbi.nlm.nih.gov/36129998/
- Publikation Tofersen-Forschung im Ambulanzpartner-Netzwerk März 2023: https://pubmed.ncbi.nlm.nih.gov/36928619
- Publikation Tofersen-Forschung im MND-NET Februar 2024: https://pubmed.ncbi.nlm.nih.gov/38384337/
In der Zulassungsstudie (VALOR-Studie) konnte in der Behandlungszeit von 28 Wochen kein statistisch signifikanter Effekt auf die ALS-Funktionsskala (ALSFRS-R) nachgewiesen werden. Daher wird an der Charité sowie weiteren ALS Zentren in Deutschland klinische Forschung zu Tofersen durchgeführt. Die Forschung erfolgt in Zusammenarbeit mit dem akademischen Netzwerk MND-NET sowie mit Ambulanzpartner-Netzwerk, das ein genetisches Screeningprogramm sowie eines systematische Datenerhebung zur Tofersen-Therapie durchführt. Dabei wird der klinische Effekt von Tofersen durch eine kontinuierliche Erfassung der ALSFRS-R über die ALS-App erfasst.
Genetische Testung zur Identifikation möglicher SOD1-Mutation
Die SOD1-Mutation ist – mit einer Häufigkeit von 2,5 % aller Betroffenen – recht selten. Allerdings hat die Mehrheit der Patienten mit SOD1-Mutationen keine Auffälligkeiten in der Familiengeschichte. Daher kommt eine genetische Untersuchung des SOD1-Gens (und anderer therapierelevanter ALS-Gene) bei allen ALS-Patienten grundsätzlich infrage. Nach einer genetischen Beratung durch spezialisierte Fachärzte für Neurologie oder Humangenetik ist die molekulargenetische Analyse sinnvoll und möglich. Für ALS-Betroffene, die nicht in einer ALS-Ambulanz in Betreuung sind oder keinen direkten Zugang zu einem Labor für ALS-Genetik aufweisen, wird eine organisatorische Unterstützung durch das ALS-Genetikprogramm von Ambulanzpartner geleistet: genetik@ambulanzpartner.de
Symptomatische Medikamente
Die ALS kann mit unterschiedlichen und variablen Symptomen verbunden sein, die mit Medikamenten behandelt werden können (symptomatische Medikamente).

In der Abbildung ist eine Auswahl der wichtigsten Symptome dargestellt, die bei einzelnen Betroffenen auftreten können.
Verminderung der Sprechstörung
Schwierigkeiten von Sprechen (Dysarthrie) und Schlucken (Dysphagie) gehören zu den häufigen Symptomen einer ALS, die besonders belastend erlebt werden.

Mit Dextromethorphan/Chinidin (DMC) und Pyridostigmin stehen Medikamente zur Verfügung, mit denen eine Verbesserung oder Stabilisierung der Symptome erreicht werden kann.
DMC ist in den USA zur symptomatischen Behandlung der ALS zugelassen und ist dort unter dem Namen „Nuedexta“ verfügbar. In Europa (und Deutschland) kann DMC durch ALS-Apotheken auf Basis einer ärztlichen Verordnung und Rezeptur herstellt und geliefert werden. Das Medikament setzt an der Verbindung (Synapsen) zwischen motorischen Nerven im Bulbärhirn an, in dem die Sprech- und Schluckfunktion reguliert wird. DMC ist ein Arzneimittel aus der Gruppe der NMDA-Antagonisten, die den Botenstoff Glutamat beeinflussen. DMC ist insbesonders wirksam, wenn eine erhöhte Muskelspannung (Spastizität, „pseudobulbäre Symptomatik) vorliegt. Eine kleine klinische Studie (24 Probanden, Beobachtungsintervall 28 Tage) konnte durch DMC eine Verbesserung der bulbären Symptomatik um 12% zeigen. Der zu erwartende Effekt ist moderat, kann aber eine Erleichterung der belastenden Symptomatik darstellen.
Pyridostigmin ist eine weitere Behandlungsoption – ein Medikament, das zur Behandlung der Muskelerkrankung Myasthenie zugelassen ist. Das Medikament setzt an der Verbindung zwischen motorischen Nerven und der Muskulatur an (neuromuskuläre Endplatte) und führt einer Stärkung der vorhandenen Muskulatur. Pyridostigmin wird bevorzugt, wenn eine Schwäche ohne erkennbare Spastizität der Zungen- und Schlundmuskulatur vorliegt (bulbäre Symptomatik ohne pseudobulbäre Komponente). Auf Grund der pharmakologischen Eigenschaften von Pyridostigmin kann als Nebenwirkung ein erhöhter Speichelfluss entstehen, der bei der ALS besonders unerwünscht ist. Diese potenzielle Nebenwirkung macht ein zusätzliches Medikament gegen Speichelfluß oder ein Absetzen von Pyridostigmin erforderlich.
4 Schritte zur Behandlung mit DMC
Bei einer Sprech- und Schluckstörung ist die Möglichkeit der Behandlung mit DMC (oder Pyridostigmin) mit der ALS-Ambulanz (oder der Facharztpraxis) abzusprechen. Bei Therapiebeginn – und auch im weiteren Behandlungsverlauf – ist die Beratung und Begleitung durch eine spezialisierte ALS-Apotheke möglich und zu empfehlen. DMC ist in Deutschland nicht als Fertigarzneimittel verfügbar, so dass hier in jedem Fall die Einbeziehung einer spezialisierten Apotheke notwendig ist.
Auf dem Weg zur Behandlung mit DMC sind 4 organisatorische Schritte notwendig:
- Kontaktaufnahme mit Ambulanzpartner und Prüfung der Eignung
- Registrieren im ALS-Apothekenprogramm
- Verordnung der Rezeptur für DMC durch Arzt in ALS-Ambulanz (oder Facharztpraxis)
- Lieferung von DMC & Therapiebegleitung durch ALS-Apotheke
Das „DMC-Programm“
Die Entscheidung für DMC ist individuell und wird maßgeblich vom Schweregrad der Sprechfunktion bestimmt.
In ALS-Apotheken wurde das DMC-Programm etabliert, das die Entscheidung für die Behandlung von DMC unterstützt.
Die abschließende Entscheidung für die DMC-Medikation wird von einem Facharzt oder einer Fachärztin für Neurologie getroffen. Dabei wird der Patient selbstverständlich mit einbezogen. In ALS-Ambulanzen ist die ALS-Funktionsskala (ALSFRS-R) eine wesentliche Orientierung in der Entscheidungsfindung. Die Sprechfunktion geht aus der ALS-Funktionsskala hervor (Fragen 1 der ALSFRS-R). Die ALSFRS-R nimmt eine besondere Stellung ein, da diese Skala sowohl vom Arzt als auch vom Patienten (ALSFRS-R-SE) erhoben werden kann.
Durch die Selbstbewertung der ALSFRS-R-SE über die ALS-App können Patienten ihre ALS-bezogenen Symptome (so auch zum Sprechen) auf strukturierte Weise mitteilen. Die Ergebnisse der ALSFRS-R-SE-Selbstbewertung können von geschulten Koordinatorinnen im Ambulanzpartner-Versorgungsnetzwerk sowie von ALS-Apotheken eingesehen werden. Bei Vorliegen einer Sprechstörung können sowohl Apotheken als auch Koordinatorinnen eine grundsätzliche Empfehlung für die DMC-Behandlung geben. Die abschließende Entscheidung liegt beim Arzt. Das Zusammenwirken von ALS-Apothekern, ALS-Koordinatorinnen, den Betroffenen und dem Arzt wird als DMC-Programm bezeichnet. Dieses Programm ist ein Angebot im Ambulanzpartner-Versorgungsnetzwerk und ein Bestandteil des ALS-Apothekenprogramms.
Das DMC-Programm hat die folgenden Inhalte:
- Erfassung von Frage 1 der ALSFRS-Funktionsskala (Sprechen) durch ALS-Apotheke
- Empfehlung der DMC-Behandlung durch ALS-Apotheke an Arzt (bei 3 bis 2 Skalenpunkten in Frage 1 der ALSFRS-R-SE)
- Übersendung einer Arztinformation und Hinweisen zur ärztlichen Verordnung von ALS-Apotheke an Patient (zur Weiterleitung an Arztpraxis)
- monatliche Selbstbewertung zum Sprechen) über ALS-App (nur bei Teilnahme an ALS-App)
- Rücksprache von ALS-Apotheke mit Patienten oder Angehörigen zur Sprechstörung sowie Empfehlung der symptomatischen Medikation durch ALS-Apotheke an Arzt
Weiterführende Links:
Tabor Gray L, Locatelli E, Vasilopoulos T, Wymer J, Plowman EK. Dextromethorphan/quinidine for the treatment of bulbar impairment in amyotrophic lateral sclerosis. Ann Clin Transl Neurol. 2023 Aug;10(8):1296-1304. doi: 10.1002/acn3.51821.
Maier A, Boentert M, Reilich P, Witzel S, Petri S, Großkreutz J, Metelmann M, Lingor P, Cordts I, Dorst J, Zeller D, Günther R, Hagenacker T, Grehl T, Spittel S, Schuster J, Ludolph A, Meyer T; MND-NET consensus group. ALSFRS-R-SE: an adapted, annotated, and self-explanatory version of the revised amyotrophic lateral sclerosis functional rating scale. Neurol Res Pract. 2022 Dec 15;4(1):60. doi: 10.1186/s42466-022-00224-6.
Kommentierung der DMC-Studie: https://als-charite.de/dmc-studie-in-den-usa-publiziert-moderate-verbesserung-von-sprechen-schlucken/
Verminderung von Speichelfluss (Sialorrhoe)
Eine überschüssige Ansammlung von Speichel im Rachen und Schlund (Sialorrhoe) gehört zu den häufigen Symptomen einer ALS, die besonders belastend erlebt werden.

Die Ursache der Sialorrhoe liegt in einer reduzierten Fähigkeit, den Speichel zu schlucken.
Die häufigsten Medikamente sind
- Ipatropiumbromid (in Form eines Mundspray)
- Pirenzepin (Tablettenform)
- Amitriptylin (Tabletten- und Tropfenform)
- Atropin (Tropfenform)
- Scopolamin (Membranpflaster, Kostenübernahme durch Kassen unsicher)
- Botulinumtoxin (Injektion in die Speicheldrüsen)
Die Behandlung der Sialorrhoe erfolgt in einer Stufentherapie (je nach Schweregrad in 3 Stufen)
- Monotherapie mit 1 Medikament (z. B. mit Ipatropiumbromid-Spray)
- Kombinationstherapie mit 2 Medikamenten (z.B. Ipatropiumbromid-Spray plus Pirenzepin)
- Kombinationstherapie mit Botulinumtoxin und 1-2 Medikamenten (z.B. Weiterführung von Ipatropiumbromid-Spray plus Pirenzepin)
Ipatropiumbromid-Spray (IPA-Spray) kein Fertigarzneimittel und wird durch ALS-Apotheken auf Basis einer ärztlichen Verordnung und Rezeptur herstellt und geliefert. Das Medikament setzt an der Verbindung (Synapsen) zwischen vegetativen Nerven und den Speicheldrüsen an, so dass die Speichelproduktion reguliert wird. IPA ist ein Mundspray und wird in als „Sprühhub“ dosiert. Die Wirkung des Speichelminderung hält wenige Stunden an. Das Medikament kann zu festgelegten Zeitpunkten (z.B. morgens, mittags und abends) oder bedarfsweise (z.B. bei Zunahme von Speichelfluss mit/nach dem Essen) eingenommen werden. Damit ist das IPA-Spray als Bedarfsmedikation einzuordnen. Der zu erwartende Effekt ist moderat, kann aber eine Erleichterung der belastenden Symptomatik darstellen.
Pirenzepin und Amitriptylin sind Basismedikamente der Sialorrhoe-Therapie und als Fertigarzneimittel verfügbarbar. Atropin erfordert eine genaue Dosiskontrolle und ist daher als „Reservemedikament“ anzusehen und in erster Wahl einzusetzen. Scopolamin Membranpflaster ist eine weitere Option der Basistherapie. Einschränkend ist die unsichere Kostenübernahme durch die gesetzliche Krankenversicherung (GKV).
Botulinumtoxin (Xeomin, Injektion in die Speicheldrüsen) wird im Abstand von 3-4 Monaten mit einer feinen Nadel in die Speicheldrüsen gespritzt. Die Injektion wird während einer Ultraschalluntersuchung durchgeführt, um das Medikament zielgerichtet in das Drüsengewebe einzubringen.
4 Schritte zur Behandlung mit IPA
Bei einer Sialorrhoe ist die Möglichkeit der Behandlung mit IPA (oder anderen speichelreduzierenden Medikamenten) mit der ALS-Ambulanz (oder der Facharztpraxis) abzusprechen. Bei Therapiebeginn – und auch im weiteren Behandlungsverlauf – ist die Beratung und Begleitung durch eine spezialisierte ALS-Apotheke möglich und zu empfehlen. IPA ist in Deutschland nicht als Fertigarzneimittel verfügbar, so dass hier in jedem Fall die Einbeziehung einer spezialisierten Apotheke notwendig ist.
Auf dem Weg zur Behandlung mit IPA sind 4 organisatorische Schritte notwendig:
- Kontaktaufnahme mit Ambulanzpartner und Prüfung der Eignung
- Registrieren im ALS-Apothekenprogramm
- Verordnung der Rezeptur für IPA durch Arzt in ALS-Ambulanz (oder Facharztpraxis)
- Lieferung von IPA & Therapiebegleitung durch ALS-Apotheke
SiALS-Programm
Die Behandlung mit speichelreduzierenden Medikamenten ist individuell und wird maßgeblich vom Schweregrad der Sialorrhoe bestimmt.

In ALS-Apotheken wurde das SiALS -Programm etabliert, das die Entscheidung für die Behandlung mit IPA und anderen Medikamenten unterstützt.
Durch die Selbstbewertung der ALSFRS-R-SE über die ALS-App können Patienten ihre ALS-bezogenen Symptome (so auch zur Sialorrhoe) auf strukturierte Weise mitteilen. Die Ergebnisse der ALSFRS-R-SE-Selbstbewertung können von geschulten Koordinatorinnen im Ambulanzpartner-Versorgungsnetzwerk sowie von ALS-Apotheken eingesehen werden. Bei Vorliegen einer Sialorrhoe können sowohl Apotheken als auch Koordinatorinnen eine grundsätzliche Empfehlung für die IPA-Behandlung geben. Die abschließende Entscheidung liegt beim Arzt. Das Zusammenwirken von ALS-Apothekern, ALS-Koordinatorinnen, den Betroffenen und dem Arzt wird als SiALS-Programm bezeichnet. Dieses Programm ist ein Angebot im Ambulanzpartner-Versorgungsnetzwerk und ein Bestandteil des ALS-Apothekenprogramms.
Das SiALS-Programm hat die folgenden Inhalte:
- Erfassung von Frage 2 der ALSFRS-Funktionsskala (Sialorrhoe) durch ALS-Apotheke
- Empfehlung der IPA-Behandlung oder Basistherapie mit Pirenzepin durch ALS-Apotheke an Arzt (bei 3 oder weniger Skalenpunkten in Frage 2 der ALSFRS-R-SE)
- Übersendung einer Arztinformation und Hinweisen zur ärztlichen Verordnung von ALS-Apotheke an Patient (zur Weiterleitung an Arztpraxis)
- monatliche Selbstbewertung zur Sialorrhoe) über ALS-App (nur bei Teilnahme an ALS-App)
- Rücksprache von ALS-Apotheke mit Patienten oder Angehörigen zur Sialorrhoe sowie Empfehlung der symptomatischen Medikation durch ALS-Apotheke an Arzt
Verminderung von unkontrolliertem Lachen oder Weinen
Infolge der ALS kann es zu einem ungewollten Lachen oder Weinen kommen. Ursache des Lachens oder Weines sind enthemmte Bewegungsabläufe (motorische Enthemmung). Gegen diese Enthemmung kommen bevorzugt die Medikamente Citalopram und Dextromethorphan/Chinidin (DMC) zum Einsatz. DMC wird durch ALS-Apotheken auf Basis einer ärztlichen Verordnung und Rezeptur herstellt und geliefert.
Therapie von Herabgestimmtheit, Unruhe oder Angst
Die Diagnose einer ALS kann mit einer erheblichen psychischen Belastung verbunden sein.
Zur Linderung dieser Beschwerden stehen antidepressive Medikamente (Citalopram, Paroxetin, Mirtazapin) oder angstlösende und sedierende Medikamente (Lorazepam, Diazepam u.a.) zur Verfügung. Die Medikamente verfügen über unterschiedliche Eigenschaften und Wirkspektren, sodass eine individuelle Auswahl des geeigneten Medikamentes im Vordergrund steht.
Behandlung von Schlafstörungen
Im Verlauf der ALS kann es durch psychische Belastungen (Grübeln) oder motorische Einschränkungen (eingeschränkter Schlafkomfort durch Lähmungen) zu Ein- oder Durchschlafstörungen kommen.
Behandlung von Spastik
Bei ca. 30 % der ALS-Betroffenen ist eine Spastik vorhanden. Bei einer spastischen Gangstörung kommt die Behandlung mit 4-Aminopyridin in Frage.
In bestimmten Situationen kann auch eine Medikamentenbehandlung mit spastiklösenden Medikamenten (Spasmolytika) sinnvoll sein.
Baclofen und Tizanidin sind die hauptsächlichen Spasmolytika bei der ALS. Bei einer fehlenden Wirksamkeit der Medikamente und Fehlhaltungen infolge der Spastik (Kontrakturen) können Botulinumtoxin-Injektionen in die spastische Muskulatur wirksam sein. Das „Weichmacher“-Medikament wird direkt in die spastische Muskulatur injiziert und ist zwei bis drei Monate wirksam. Bei einer hochgradigen Spastik in unterschiedlichen Körperbereichen, die durch Botulinumtoxine oder andere Spasmolytika nicht zugänglich sind, kommt die Verwendung cannabishaltiger Arzneimittel in Frage (Cannabinoide). Durch eine Neuordnung der Gesetzgebung zu cannabishaltigen Arzneimitteln ist die Medikamentengruppe für Menschen mit ALS verfügbar. Dabei ist die Versorgung durch Ärztinnen, Ärzte und Apotheken anzuraten, die mit Cannabinoiden bei der ALS vertraut sind.
Therapie von Muskelkrämpfen
Krämpfe der Muskulatur (Crampi) können ein belastendes und schmerzhaftes Begleitsymptom der ALS sein. Sie können mit Medikamenten mit unterschiedlichen Wirkprofilen behandelt werden (Chinidin, Mytidin oder cannabishaltige Medikamente).
Linderung von Atemanstrengung
Eine geschwächte Atemmuskulatur kann bei der ALS zu einer Atemanstrengung (Dyspnoe) oder einer Verminderung des Hustenstoßes führen.
Behandlung von Schmerzen
Die ALS ist grundsätzlich keine schmerzhafte Erkrankung, da das sensible Nervensystem nicht betroffen ist. Dennoch kann es in Folge der ALS zu Schmerzen kommen, die durch Medikamente behandelbar sind.
Hilfsmittel & Assistenztechnologie
Die Hilfsmittelversorgung gehört zu den wichtigsten Maßnahmen, um Menschen mit ALS eine private oder soziale Teilhabe zu ermöglich. Sie stärken bestehende Funktionen (z. B. Bewegungstrainer zur Kräftigung der Arme und Beine oder Fußheberorthese zur Stabilisierung des Fußgelenks) oder reduzierte Muskelfunktionen aus (z. B. Rollstuhlversorgung bei eingeschränkter Steh- und Gehfähigkeit).
Hilfsmittel werden nach den persönlichen Bedürfnissen der Erkrankten sowie ihrer Angehörigen gestaltet – nach dem Grundsatz: So wenig wie möglich, aber so viel wie notwendig.
Orthesen
Orthesen sind Hilfsmittel, die zur Stabilisierung, Entlastung, Führung oder Korrektur einer Extremität oder des Rumpfes eingesetzt werden.

Fußheberorthesen reduzieren eine Fall- oder Spitzfußneigung, die durch eine Schwäche oder Spastik entstehen kann.
Transferhilfen
Bei einer hochgradigen Muskelschwäche oder Spastik kann der Transfer eines Patienten erschwert sein.

Für den Transfer stehen sehr unterschiedliche Transfer- und Liftersysteme zur Verfügung (Rutschbretter, Badewannenlifter, mobile Transferlifter, Deckenlifter, Treppenlifter, Rollstuhllifter).
Bewegungstrainer
Bewegungstrainer sind therapeutische Bewegungsgeräte, die speziell für den täglichen Einsatz zuhause konzipiert sind und täglich zum Einsatz kommen können.

Sie ermöglichen durch einen integrierten Elektromotor kreisförmige Bewegungen der Arme und der Beine (passive Bewegung).
Rollstühle
Elektrorollstühle mit einer Hub-, Liege- und Stehfunktion sind geeignet, den Körper in die gewünschte Körperposition zu bringen – auch wenn eine hochgradige Muskelschwäche oder Spastik vorliegt.

Bei einer Einschränkung manueller Funktionen oder Verlust der Finger- und Handbeweglichkeit kommen verschiedene Sondersteuerungen zur Anwendung.
Kommunikationshilfen & Umfeldsteuerung
Kommunikationshilfen verringern Einschränkungen beim Sprechen, Schreiben und in der Computernutzung, die aufgrund einer Sprechstörung oder Schwäche der Handmuskulatur auftreten.

Tablet-Computer stehen zur Verfügung, um Texte zu erstellen, die von der Kommunikationshilfe vorgelesen, angezeigt oder per E-Mail versendet werden können.
Bei einer Muskelschwäche oder Spastik der Finger, Hände und Arme ist das eigenständige Greifen und Hantieren erschwert oder nicht mehr möglich. In dieser Situation können individuelle Lösungen der Umfeldsteuerung die Selbstständigkeit im Alltag unterstützen. Durch die Verknüpfung von Sondersteuerung mit bestimmten elektronischen Bauelementen an Alltagsgegenständen kann die Steuerung von Fernsehgeräten, Lichtschaltern, Fenstern, Türen, Lüftungen, Jalousien und anderen Gegenständen und Geräten erreicht werden.
Ergo- und Physiotherapie, Logopädie
Ergo- und physiotherapeutische sowie logopädische Behandlungen (Heilmitteltherapien) bilden einen zentralen Ansatz, um Einschränkungen durch Muskelschwäche und -anspannung bei der ALS abzumildern.
Ergotherapie
Die Ergotherapie dient der Stärkung, Aufrechterhaltung oder Kompensation feinmotorischer Leistungen (z. B. Funktionen der Hände), die durch die ALS eingeschränkt werden können. Sie trainiert alltagsrelevante Tätigkeiten im privaten und im Arbeitsumfeld.

Physiotherapie
Mit einer Physiotherapie werden Muskelgruppen aktiviert und die Folgen der ALS-bedingten Kraftminderung reduziert (Sehnenverkürzungen, Gelenkkapselschmerzen, Arthrosen und Lymphödeme).

Die Auswahl der geeigneten Therapieform und der notwendigen Behand- lungsintervalle gehört zu den wichtigsten Entscheidungen bei der ALS-Versorgung.
Logopädie
Unter dem Begriff Logopädie werden sehr unterschiedliche Therapieverfahren für Menschen mit Sprach-, Sprech- und Schluckstörungen zusammengefasst.

Tatsächlich bleiben bei der ALS die Wortfindung und das Sprachverständnis erhalten. Betroffen sind vielmehr die motorischen Funktionen des Sprechens und Schluckens.
Ernährungstherapie
Mehr als 50 % aller Menschen mit ALS sind von einem unerwünschten Gewichtsverlust betroffen. Eine positive Ernährungsbilanz ist daher ein wichtiges Behandlungsziel bei der ALS.

Der Gewichtsverlust entsteht hauptsächlich infolge einer Schluckstörung und der damit verbundenen Mangelernährung.
Die Grundregel lautet, eine hochkalorische, fettreiche Ernährung zu erreichen. Die Nahrungsumstellung kann durch Trinknahrung ergänzt werden. Dabei handelt es sich um verordnungsfähige Medizinprodukte, die mit relativ geringen Trinkmengen eine hohe Energiezufuhr ermöglichen (1,5-2 kcal/ml). Passende Produkte und ihre Dosierung werden im Arzt-Patienten-Dialog sowie in einer Ernährungsberatung bestimmt.
Sollte die Nahrungsaufnahme auf natürlichem Weg zu stark beeinträchtigt sein, können Patienten sich für die Anlage einer Ernährungssonde (perkutane endoskopische Gastrostomie, PEG) entscheiden. Die PEG-Anlage ist ein etabliertes und risikoarmes Operationsverfahren nach der „Schlüssellochtechnik“ (Endoskopie). Durch einen spezialisierten Internisten wird während einer Magenspiegelung eine kleine Öffnung in der Bauchdecke auf Höhe des Magens geschaffen. Wie beim Stechen eines Ohrlochs zum Tragen von Ohrschmuck verheilt diese Wunde anschließend, sodass eine schmerzlose Körperöffnung besteht. In die entstandene Öffnung wird ein Kunststoffschlauch gelegt, durch den Flüssigkeiten und Ernährungslösungen verabreicht werden können. Auf diese Weise kann die ausreichende Energie- und Nährstoffzufuhr sichergestellt werden, selbst wenn eine hochgradige Schluckstörung vorliegt. Wichtig ist, dass auch nach Anlage einer PEG-Sonde die Nahrungsaufnahme durch den Mund unverändert fortgeführt werden kann (sofern motorisch möglich).
Der richtige Zeitpunkt spielt bei der PEG-Anlage eine wichtige Rolle: Patienten sollten nicht so lang warten, bis eine Schwächung des Körpers eingetreten ist und eine eingeschränkte Operationsfähigkeit besteht. Die Entscheidungen rund um eine Ernährungstherapie und über den richtigen Zeitpunkt einer PEG-Anlage ist Teil des vertrauensvollen Gesprächs zwischen Patient, Arzt und Ernährungstherapeut.
Atemhilfen
Bei der ALS kann die Atmung durch unterschiedliche Faktoren beeinträchtigt werden. Der häufigste ist eine Schwäche der Atemmuskulatur (Zwerchfell, Rippenmuskulatur, Bauchmuskeln).
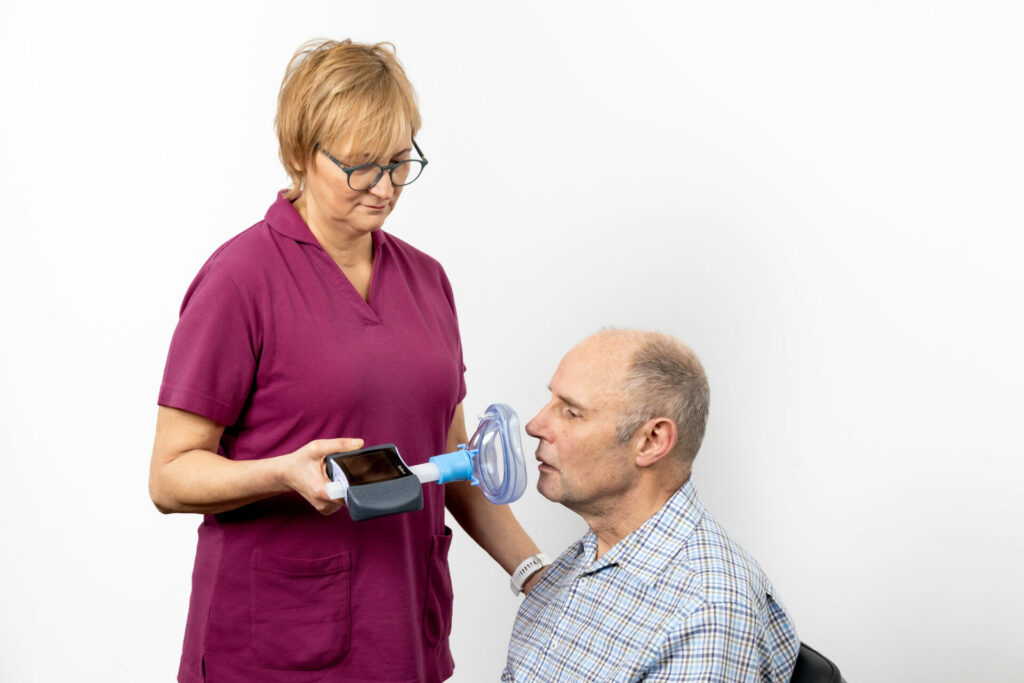
Das Ein- und Ausatmen strengt immer mehr an und die Atemleistung reduziert sich (Hypoventilation). Kohlendioxid wird nicht mehr ausreichend ausgeatmet.
Nichtinvasive Beatmung
Die Maskenbeatmung ist eine mechanische Atemhilfe, die einen Teil der Atemarbeit übernimmt, die sonst vollständig von den Atemmuskeln verrichtet wird.
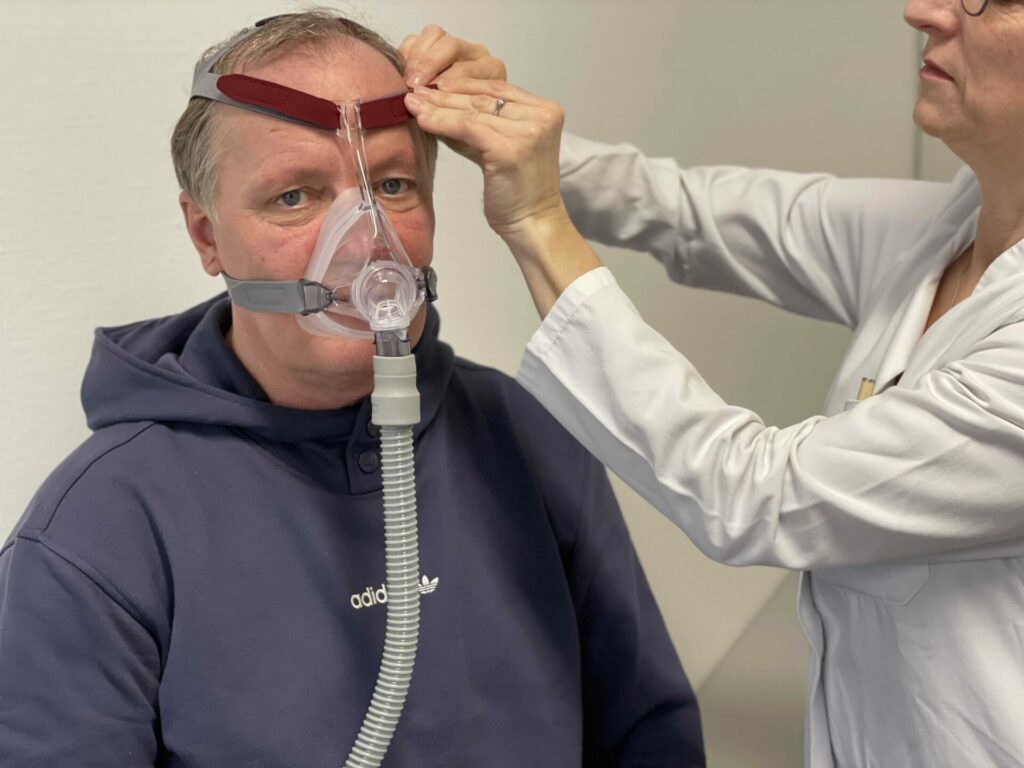
Mit Hilfe eines Heimbeatmungsgeräts wird über eine Atemmaske Raumluft (kein zusätzlicher Sauerstoff) in die Atemwege gebracht.
Die Maskenbeatmung wird während eines kurzen Krankenhausaufenthaltes (5-10 Tage) angepasst und kann zu Hause eigenständig genutzt werden. Es erfolgt kein Eingriff an den Atemwegen (nichtinvasive Beatmung).
Die Beatmungsmaske wird auf dem Gesicht und meist im Liegen während des Schlafens getragen, im Einzelfall auch tagsüber. Sie kommt vollständig zur Geltung, wenn die Beatmungszeit mindestens 8 Stunden im Tagesverlauf beträgt. Schreitet die Atemschwäche fort und erlebt der Patient die Maskenbeatmung als positiv für sein Wohlbefinden, kann die Beatmungszeit auch erweitert werden.
Hustenassistent
Ein Hustenassistent (mechanischer Insufflator-Exsufflator) wird notwendig, wenn die Hustenkraft reduziert ist.

Das Gerät führt dem Patienten über die Maske einen Luftstrom zu (entspricht einem tiefen Einatmen), um diese mit einer hohen Geschwindigkeit wieder abzusaugen (entspricht dem Ausatmen).
Invasive Beatmung
Ist die Atemmuskulatur hochgradig geschwächt, kann die Atem- oder Hustenarbeit nicht vollständig durch die Maskenbeatmung und Hustenassistenz kompensiert werden.

Dann besteht die Möglichkeit, die Atemschwäche durch einen Luftröhrenschnitt und eine mechanische Beatmung (invasive Beatmungstherapie) auszugleichen.
Diese Beatmungstherapie ist in Pflegeeinrichtungen oder Wohngemeinschaften möglich, die sich auf eine intensivpflegerische Versorgung spezialisiert haben. Bei günstigen Voraussetzungen kann sie auch zu Hause von einem Pflegeteam realisiert werden. Eine wesentliche Grenze der invasiven Beatmungsversorgung besteht in der Einschränkung der Privat- und Intimsphäre der Patienten und ihrer Angehörigen, da Pflegepersonal kontinuierlich tätig und anwesend ist.
Vor diesem Hintergrund ist eine invasive Beatmung nicht für alle ALS-Patienten eine passende Behandlungsform. Sie wird bei weniger als 10 % der Patienten in Deutschland eingesetzt. Die Entscheidung dafür entsteht in einer bewussten Abwägung ihrer Vorteile und Belastungen.
Patientenverfügung & Vorsorgevollmacht
In der Behandlung der ALS bestehen erhebliche individuelle Unterschiede – so auch in der Haltung der Betroffenen zu lebensverlängernden Maßnahmen.
Zur Erleichterung von Entscheidungsfindung und Dokumentation haben wir das Muster einer Patientenverfügung entwickelt, die auf typische Entscheidungssituationen bei der ALS zugeschnitten ist.
Dazu zählen die Entscheidung über eine Ernährungsversorgung (z. B. mit einer Ernährungssonde), die Atemhilfe (z. B. durch eine Atemmaske oder einen Hustenassistenten) sowie die Lebensverlängerung durch eine „künstliche Beatmung“ (Beatmung über Tracheostoma). Hinzu kommt die Meinungsbildung zu palliativmedizinischen Medikamenten, die einerseits eine Symptomlinderung erreichen, aber zugleich die verbleibende Lebensspanne verkürzen können. Auf Grund dieses „Doppeleffektes“ ist zur Verwendung von palliativmedizinischen Medikamenten (z. B. Morphinen) eine Erhebung des Patientenwillens auf einer Patientenverfügung sinnvoll.
Eine Besonderheit der vorliegenden Muster für eine Patientenverfügung besteht darin, dass nicht nur eine Ja-Nein-Entscheidung von lebensverlängernden Maßnahmen (z. B. PEG) möglich ist, sondern die Zeitpunkte und Umstände festgelegt werden können, in denen bestehende Maßnahmen wieder beendet werden können. Eine typische Patientenverfügung anderer Institutionen bietet meist die Entscheidung zwischen der Annahme und Ablehnung von lebensverlängernden Maßnahmen (z. B. PEG) ab. Unsere vorliegende Patientenverfügung macht ebenfalls eine Annahme oder Ablehnung von Maßnahmen möglich, aber bietet darüber hinaus die Möglichkeit, eine lebenszeitverlängernde Maßnahme (z. B. PEG) anzunehmen und zu einem späteren Zeitpunkt abzulehnen. So werden ALS-typische Konstellationen benannt, die zu einem Abbruch von Behandlungsmaßnahmen führen (z. B. Verlust der Kommunikationsfähigkeit, Beginn einer Demenz oder einer sonstigen schwierigen Gehirnfunktionsstörung. Dieses differenzierte Vorgehen in der Willensbekundung zur Ernährungs- und Beatmungstherapie widerspiegelt das Bedürfnis von mehr als 90% als ALS-Betroffenen, lebenszeitverlängernde Maßnahmen zu nutzen, aber zu einem individuellen Zeitpunkt zu begrenzen oder abzubrechen.
Die Patientenverfügung ist ein Dokument zur Willensbekundung einer Patientin/ eines Patienten, das für die ärztliche Entscheidungsfindung eine wichtige Orientierung darstellt. Die abschließende Entscheidungsfindung und damit verbundene Verantwortung liegt unverändert in ärztlicher Hand. So ist nicht in jedem Fall eine Maximaltherapie (z. B. mit künstlicher Beatmung) ärztlich begründet (z. B. bei ALS mit Demenz). So können Situationen entstehen, dass der Patientenwille aus ärztlicher Perspektive nicht realisiert werden kann. Verbindlich ist jedoch die Patienten-seitige Festlegung von Therapiebegrenzung. So ist die Dokumentation des Patientenwillens von Verzicht oder Abbruch bestimmter Behandlungsmaßnahmen für die ärztliche Entscheidungsfindung verbindlich. Eine Behandlung gegen Patientenwillen soll mit der vorliegenden Verfügung verhindert werden.
Wir empfehlen ihren die Beschäftigung mit der Patientenverfügung und Klärung offener Fragen im Arzt-Patienten-Gespräch. Nach Abschluss (oder Aktualisierung) der Patientenverfügung sind wir für eine Zusendung des Dokumentes dankbar (sofern Sie sich an unserer Ambulanz in Behandlung befinden). Eine Kopie der Patientenverfügung würde Bestandteil der Patientenakte werden. Zusätzlich ist die Ausstellung eines Palliativausweises möglich, auf dem die Therapiebegrenzung dokumentiert ist (Kurzversion der Patientenverfügung in Größe einer Visiten-Karte, die auch in der Brieftasche zu führen ist). Weiterhin empfehlen wir die Bereitstellung des Dokumentes für Ambulanzpartner (sofern sie Teilnehmer des Versorgungsnetzwerkes sind). Damit würde das Dokument digitalisiert und in der elektronischen Versorgungsakte gespeichert werden. In diesem Fall können Sie eine Kopie der Patientenverfügung in unserer Ambulanz hinterlassen und um die Weitersendung an Ambulanzpartner bitten. Alternativ können Sie einen Scan der Patientenverfügung an Ambulanzpartner per Mail zusenden:
datenmanagement@ambulanzpartner.de.
Hier finden Sie zwei Dokumentversionen der Patientenverfügung. Eine erste Version ist für den Ausdruck optimiert, sodass Sie handschriftlich Ihre individuellen Daten und Beschlüsse eintragen können. Eine zweite Version ist für die Erstellung am Computer (Interaktives PDF) optimiert. Beide Versionen sollten ausgedruckt und unterschrieben werden. Wenn keine Unterschrift aus motorischen Gründen möglich ist, empfehlen wir die notarielle Beglaubigung.
Patientenverfügung zur Erstellung:
Vorsorgevollmacht zur Erstellung:
Palliativversorgung
Die Palliativversorgung dient der Linderung und Abschirmung (Palliation) belastender Symptome. Sie zielt auf eine effektive Behandlung sehr unterschiedlicher Beschwerden wie Schmerzen, Unruhe und Atemanstrengung.
Sie wird meist mit beruhigenden, entkrampfenden und schmerzlindernden Medikamenten umgesetzt (z. B. mit Medikamenten aus der Gruppe der Benzodiazepine, Cannabinoide und Morphine).
Die Palliativbehandlung ermöglicht es Patienten, dass sie in der letzten Lebensphase wesentliche Erleichterungen erfahren. Eine Verlängerung der Lebenszeit steht dabei nicht im Vordergrund. Eine Palliativversorgung kann gewählt werden, wenn medizintechnische Maßnahmen nicht möglich oder ausgeschöpft sind, als belastend erlebt oder seitens des Patienten aus grundsätzlichen Erwägungen nicht gewünscht werden.
Beispielsweise kann die Maskenbeatmung nicht bei allen Menschen mit ALS eingesetzt werden. Ein Teil der Betroffenen erlebt sie als eine starke Belastung, etwa durch das Fremdkörpergefühl der Atemmaske, sodass sie diese Therapieform für sich ablehnen. Ein anderer Teil möchte auf Grund persönlicher Werte und Schlussfolgerungen nicht beatmet werden und keine lebensverlängernden Maßnahmen in Anspruch nehmen (Therapiebegrenzung). In dieser Situation können sich Patienten für eine Palliativversorgung entscheiden: Anstelle der Maskenbeatmung stehen Medikamente zur Verfügung, die zur Linderung der Atemanstrengung und anderer belastender Symptome geeignet sind.
Morphine und andere palliative Medikamente können einen „Doppeleffekt“ hervorrufen. Darunter ist zu verstehen, dass diese Medikamente zu einer Linderung von Symptomen führen, aber zugleich mit einer Verkürzung der verbleibenden Lebensspanne verbunden sein können, wenn die Atemfunktion durch die ALS ohnehin hochgradig eingeschränkt ist. Der beruhigende Effekt des Medikamentes führt dann möglicherweise zu einer weiteren Dämpfung der Atemfunktion, welche die körpereigene Kohlendioxid-Anreicherung verstärkt und den Sterbeprozess beschleunigt, der sich ohne Medikation zu einem etwas späteren Zeitpunkt eingestellt hätte. Vor der Einleitung einer Palliativversorgung ist es daher besonders wichtig, die Behandlungsziele im Arzt-Patienten-Dialog festzulegen und das Bewusstsein und die Akzeptanz für einen möglichen Doppeleffekt beim Patienten und seinen Angehörigen zu prüfen.
Eine Palliativversorgung kann auch von großer Bedeutung sein, wenn Patienten mit bereits bestehenden lebensverlängernden Maßnahmen zu dem Entschluss kommen, diese zu beenden. Wird eine Beatmungstherapie eingestellt, entsteht durch den Entzug vom Beatmungsgerät möglicherweise eine Atemanstrengung und Unruhe. Durch geeignete palliativmedizinische Maßnahmen wie sedierende Medikamente können belastende Symptome von palliativmedizinisch spezialisierten Ärzten effektiv behandelt und vollständig verhindert werden.


