Grundlagen
Amyotrophe Lateralsklerose (ALS) ist eine schwere, bisher nicht heilbare Erkrankung des motorischen Nervensystems. Bei der ALS verlieren die motorischen Nervenzellen, die für die willkürliche Steuerung der Muskulatur verantwortlich sind, fortschreitend ihre Funktion.
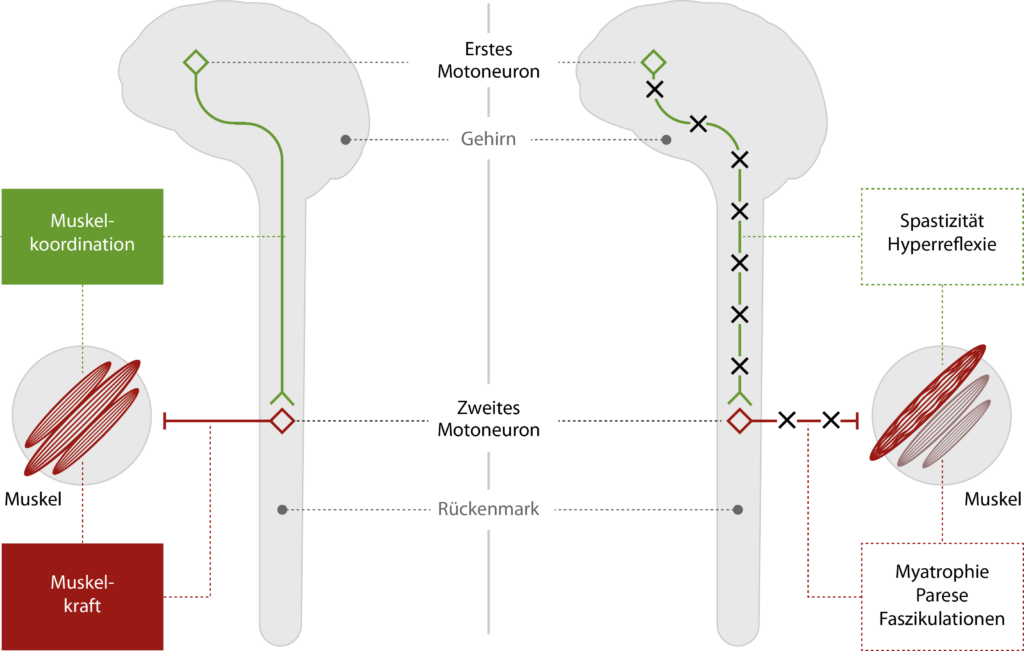
Abbildung: Aufbau des motorischen Nervensystems und typische Symptome der ALS. Bei der ALS kommt es zu einer Degeneration der Motoneurone, die für die Steuerung der Willkürmuskulatur verantwortlich sind. Die Schädigung des ersten Motoneurons (im motorischen Kortex) verursacht eine Spastizität (Bewegungsstörung), während die Degeneration des zweiten Motoneurons (im Myelon) mit Muskelschwäche (Parese), Muskelatrophie (Myatrophie) oder Muskelzuckungen (Faszikulationen) verbunden ist.
Der Abbau von Nervenzellen (Neurodegeneration) stellt sich für Menschen mit ALS vor allem als Kraftminderung und Muskelschwäche, Muskelschwund oder Steifigkeit dar. Der Nervenzellverlust hat zur Folge, dass die Mobilität der Hände, Arme, Beine sowie des Rumpfes und der Zunge im Laufe der Krankheit eingeschränkt wird oder verloren geht. Nicht betroffen von der ALS sind die Körperwahrnehmung und Sinneswahrnehmungen (Sehen, Hören, Schmecken, Riechen, Gleichgewichtssinn, Tastsinn). Auch die Herzmuskulatur und die Kontrolle von Urin und Stuhl bleiben meist unberührt. Im fortgeschrittenen Krankheitsverlauf kann es zur vollständigen Lähmung der Skelettmuskulatur kommen. Die ALS zählt daher zu einer der schwersten Erkrankungen des Menschen. Sie ist nicht heilbar, durch eine Behandlung können ihre Symptome jedoch gelindert werden.
Häufigkeit
In Deutschland leben 6.000 bis 8.000 Menschen mit ALS. Die Erkrankung wird jährlich bei etwa 2.000 Patienten neu diagnostiziert. Die meisten von ihnen sind zwischen 50 und 70 Jahre alt. Das Durchschnittsalter liegt zwischen 56 und 58 Jahren. 10 % erkranken vor dem 40. Lebensjahr. Die jüngsten Patienten sind zwischen 20 und 30 Jahre alt. Männer erkranken etwas häufiger als Frauen.
Zelluläre und molekulare Veränderungen
Die ALS wurde erstmalig im Jahr 1869 durch den französischen Neurologen Jean-Martin Charcot beschrieben und als „Amyotrophe Lateralsklerose“ bezeichnet. Er kam zu der Erkenntnis, dass die ALS durch einen Untergang (Degeneration) motorischer Nervenzellen in Gehirn und Rückenmark entsteht.
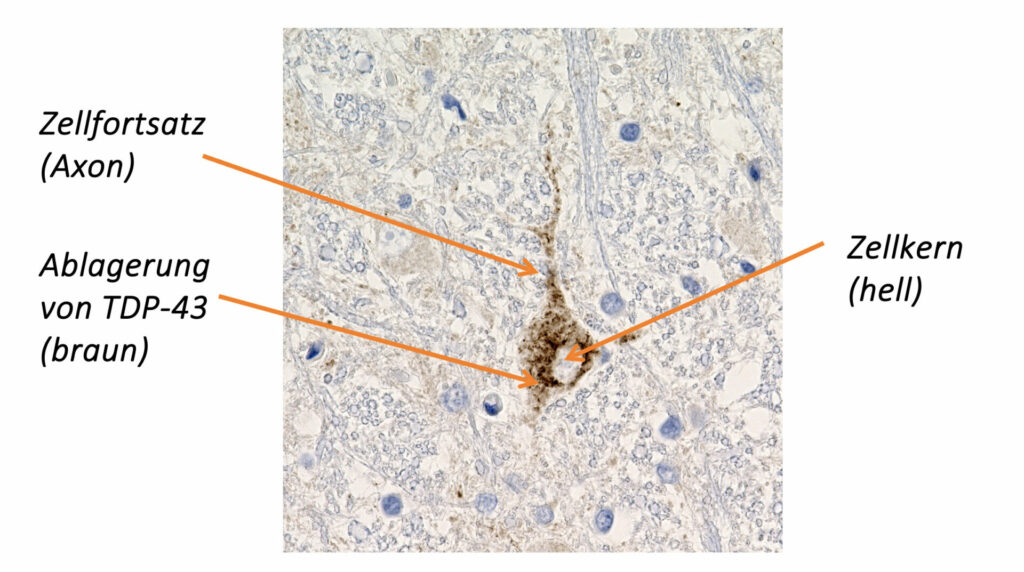
In den 1950er-Jahren konnten ALS-Forscher durch mikroskopische Untersuchungen von Gehirn- und Rückenmarksgewebe ALS-typische Ablagerungen von Eiweißen feststellen.Erst seit dem Jahr 2006 ist es gelungen, die molekulare und chemische Zusammensetzung dieser pathologischen Ablagerungen in den motorischen Nervenzellen zu analysieren. Ein hauptsächlicher Bestandteil der Ablagerungen besteht aus dem Eiweiß (Protein) TDP-43. Darüber hinaus konnte gezeigt werden, dass sich neben dem TDP-43 auch andere Proteine (z. B. SOD1, FUS) in der motorischen Nervenzelle ablagern können.
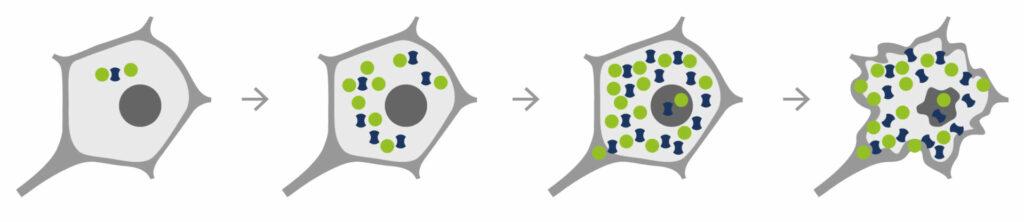
Ein Grundprinzip der ALS besteht darin, dass natürlich vorkommende Eiweiße eine Strukturänderung erfahren – ihre Form ändert sich (Konformationsänderung). Durch die Verformung kommt es zu einer gegenseitigen Anziehung der Eiweiße und es entstehen Zusammenballungen (Proteinaggregate). Nach dem Schneeballprinzip verbinden sich mehr und mehr Eiweiße miteinander. In der Konsequenz ist die Nervenzelle mit Proteinaggregaten überladen und kann ihre Funktion nicht mehr ausüben. Dieser Prozess der schädlichen Eiweißablagerung wird Proteinopathie genannt.
Genetische Faktoren
Bei 5-10 % aller Menschen mit ALS sind mehrere Familienmitglieder von ALS betroffen – es liegt eine familiäre ALS (F-ALS) vor. Die Rolle genetischer Faktoren wird noch unterschätzt, da bei mindestens 5 % aller Patienten, die keine Familiengeschichte einer ALS aufweisen, genetische Veränderungen vorliegen.
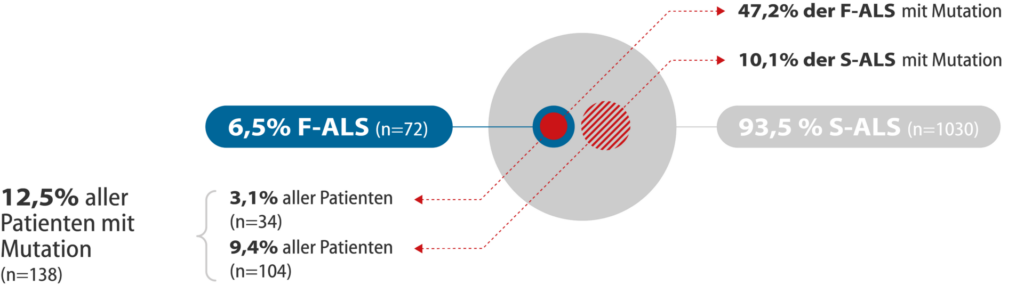
Abbildung: Häufigkeit von familiärer (F-ALS) und sporadischer ALS (S-ALS). Ergebnisse aus dem genetischen Screening-Programm in Deutschland
Das wesentliche Kennzeichen einer F-ALS ist die Erkrankung (oder Vorgeschichte) weiterer Familienmitglieder an einer ALS. Bei einer Familiengeschichte ohne Hinweis auf eine ALS ist grundsätzlich von einer nicht-erblichen Form der ALS auszugehen („sporadische ALS“, S-ALS). Durch zunehmende wissenschaftliche Erkenntnisse wird jedoch bekannt, dass genetische Faktoren auch bei der sporadischen ALS eine größere Bedeutung haben können.
Die Ursachen der FALS werden kontinuierlich weiter aufgeklärt. Seit 1993 wurden über 15 Gene identifiziert, bei denen bestimmte Fehler (Mutationen) zu einer FALS führen können. Die häufigsten Mutationen finden sich in den Genen „C9orf72“, „SOD1“, „FUS“, „TARDBP“ und „TBK1“. Die genetische Diagnostik ohne Familiengeschichte einer ALS bedarf einer sorgfältigen, individuellen Abwägung und ärztlichen Beratung. Dabei ist zu beachten, dass bereits das Wissen um das Vorliegen einer Mutation mit psychosozialen Belastungen für die Betroffenen und/oder die genetisch-verwandten Familienmitglieder bedeuten kann. Gleichzeitig kann der Nachweis einer genetischen Veränderung (insbesondere im SOD1-Gen) mit einer Therapieoption (einer Behandlung mit dem genetischen Medikament Tofersen) verbunden sein. In jedem Fall sollte eine molekulargenetische Untersuchung von ALS-Genen erst nach einer fachärztlichen Beratung realisiert werden, in der Ziele, Grenzen und potentiellen Belastungen der humangenetischen Diagnostik dergestellt werden.
Symptome
Zu Beginn der ALS nehmen Patienten überwiegend Muskelschwäche (Parese), Muskelschwund (Atrophie) sowie Muskelsteifigkeit (Spastik) wahr. Die individuellen Beschwerden hängen davon ab, welches Motoneuron und welche Muskelgruppe stärker betroffen ist.

Zu 60 bis 70 % treten die ersten Symptome an den Extremitäten auf. In diesen Fällen bemerken Patienten eine Ungeschicklichkeit der Hände, eine Gangunsicherheit oder eine Schwäche der Beine. Zu 30 bis 40 % stellen sich die ersten Symptome beim Sprechen und Schlucken ein (bulbärer Krankheitsbeginn). Bei diesen Patienten ist die Zungen-, Schlund- und Gaumenmuskulatur beeinträchtigt.
Mobilitätseinschränkungen
Durch Muskelschwund und Steifigkeit wird die betroffene Extremität fortschreitend gelähmt. Sind zuerst die untern Extremitäten (Beine und Füße) betroffen, bedeutet dies eine zunehmende Gehstörung bis hin zur Notwendigkeit einer Gehstütze oder eines Rollstuhls. Bei den oberen Extremitäten werden das Heben, Tragen, Schreiben, Schneiden, Essen und die Körperpflege fortschreitend beeinträchtigt.
Sprechstörung (Dysrthrie)
Wenn die Symptome an Zunge, Schlund und Gaumen betreffen, kann eine Sprechstörung (Dysarthrie) entstehen. Das Sprechen und die Artikulation fallen immer schwerer bis hin zur Unfähigkeit, verbal zu kommunizieren. In diesem Fall können Kommunikationshilfen notwendig werden.
Schluckstörung (Dysphagie)
Die Schluckstörung beginnt meist mit einer leichten Schwäche oder Steifigkeit der Zungen- und Schlundmuskulatur. Im weiteren Krankheitsverlauf nimmt die Beweglichkeit der Muskulatur ab. Bei einer hochgradigen Schluckstörung ist die Kau- und Schluckmuskulatur schwer oder vollständig gelähmt und das Schlucken von Nahrung kaum oder nicht mehr möglich. Sehr fest oder dünnflüssige Nahrungsmittel bereiten Schwierigkeiten. Eine spezielle Nahrungszusammenstellung oder Ernährungshilfen werden notwendig, um einem Gewichtsverlust entgegen zu wirken.
Atemfunktionsstörung
Die Einschränkung der Atemfunktion entsteht durch eine Schwäche der Atemmuskulatur am Brustkorb und des Zwerchfells. Je nach Krankheitsverlauf können verschiedene Atemhilfen genutzt werden. In Deutschland wird bei etwa 30 % aller Patienten eine Maskenbeatmung und bei bis zu 10 % eine invasive Beatmung mit Luftröhrenschnitt eingesetzt.
Diagnosestellung
Die wesentlichen Hinweise für eine ALS ergeben sich bereits durch eine körperliche Untersuchung. Neurologisch ausgebildete Ärzte sind in der Lage, ALS-typische Symptome festzustellen. Typischerweise liegen bei ALS-Patienten keine Gefühlsstörung, Nervenschmerzen oder geistigen Einschränkungen vor.
Ausschluss von Krankheiten mit ähnlichen Symptomen
Einige sehr seltene Erkrankungen können ALS-ähnliche Symptome aufweisen. Zu ihnen zählen eine mechanische Schädigung des Rückenmarks (zervikale Myelopathie), Muskelerkrankungen (z.B. Einschlusskörperchenmyopathie), Erkrankungen der peripheren Nerven (motorische Polyneuropathie), bestimmte Formen der Multiplen Sklerose, neurologische Folgeerkrankungen durch Tumore (paraneoplastische Syndrome) und sehr seltene Stoffwechselerkrankungen. Um diese Erkrankungen nachzuweisen oder auszuschließen, stehen verschiedene Untersuchungsmethoden zur Verfügung: Magnetresonanztomographie (Tumor- oder Entzündungserkrankungen des Gehirns und Rückenmarks), Nervenwasseruntersuchung (Infektionen und Autoimmunerkrankungen) oder spezifische Blutuntersuchungen (Stoffwechselerkrankungen, Autoimmunerkrankungen und bestimmte Tumorerkrankungen).
Obwohl die ALS-ähnlichen Erkrankungen sehr selten sind, werden die Untersuchungsverfahren der Zusatz- und Ausschlussdiagnostik mehrheitlich eingesetzt, um eine größtmögliche diagnostische Sicherheit zu erlangen. Bei einem Teil der Betroffenen kann der körperliche Untersuchungsbefund so aussagekräftig sein, dass die klinischen Kriterien einer ALS auch ohne Zusatz- und Ausschlussdiagnostik vorliegen. In diesem Fall kann auf die genannten Untersuchungsverfahren verzichtet werden.
Verlauf und Prognose
Die ALS verläuft bei jedem Patienten unterschiedlich. Der individuelle Krankheitsverlauf ist davon geprägt, in welcher Muskelgruppe die Symptome auftreten.

Mobilitätseinschränkungen
Durch Muskelschwund und Steifigkeit wird die betroffene Extremität fortschreitend gelähmt. Sind zuerst die untern Extremitäten (Beine und Füße) betroffen, bedeutet dies eine zunehmende Gehstörung bis hin zur Notwendigkeit einer Gehstütze oder eines Rollstuhls. Bei den oberen Extremitäten werden das Heben, Tragen, Schreiben, Schneiden, Essen und die Körperpflege fortschreitend beeinträchtigt.
Sprech- und Schluckstörung
Bei 30 % der Betroffenen entstehen eine Sprech- und Schluckstörung („bulbäre Symptome“) im frühen Krankheitsverlauf, während bei der Mehrheit der Betroffenen die Sprech- und Schluckstörung im späteren Verlauf – zusätzlich zur Schwäche an den Extremitäten – auftreten. Etwa 80 % aller Menschen mit ALS erfahren im Krankheitsverlauf eine Schluckstörung.
Atemfunktionsstörung
Je nach Krankheitsverlauf können verschiedene Atemhilfen genutzt werden. In Deutschland wird bei etwa 30 % aller Patienten eine Maskenbeatmung und bei bis zu 10 % eine invasive Beatmung mit Luftröhrenschnitt eingesetzt.
Lebenszeit
Die mittlere zu erwartende Lebenszeit von Menschen mit ALS beträgt nach der Diagnosestellung 3 bis 5 Jahre. Etwa 10 % haben einen langsamen Verlauf der ALS mit längeren Überlebenszeiten. Bei einem Teil der Patienten sind Verläufe von mehr als 10 Jahren bekannt. Die statistischen Angaben beziehen sich auf den Krankheitsverlauf ohne Berücksichtigung von modernen Behandlungsoptionen. Durch die Nutzung von Atemhilfen (Maskenatmung, invasive Beatmung) und Ernährungshilfen (Trinknahrung, Ernährungssonde) kann eine Lebenszeitverlängerung von wenigen Monaten bis hin zu vielen Jahren erreicht werden, abhängig von den eingesetzten Behandlungsverfahren und vom individuellen Krankheitsverlauf. Die Prognose der Erkrankung wird von verschiedenen Faktoren bestimmt, die komplex sind und in der Gesamtheit betrachtet werden müssen.